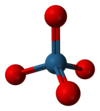
四氧化锇
| 四氧化锇 | |||
|---|---|---|---|
| |||

| |||
| IUPAC名 Osmium tetraoxide | |||
| 识别 | |||
| CAS号 | 20816-12-0 | ||
| PubChem | 30318 56370778((monopotassiate)) 75811001((monoquinuclidiniate)) 53113021((monotemediate)) | ||
| ChemSpider | 28158 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | VUVGYHUDAICLFK-UHFFFAOYSA-N | ||
| UN编号 | UN 2471 | ||
| EINECS | 244-058-7 | ||
| ChEBI | 88215 | ||
| RTECS | RN1140000 | ||
| MeSH | Osmium+tetroxide | ||
| 性质 | |||
| 化学式 | OsO4 | ||
| 摩尔质量 | 254.23 g·mol⁻¹ | ||
| 外观 | 无色或浅黄色半透明固体 | ||
| 密度 | 4.9 g/cm³ (固) | ||
| 熔点 | 40.25 °C | ||
| 沸点 | 130 °C | ||
| 危险性 | |||
| 欧盟危险性符号 | |||
| 警示术语 | R:R26/27/28, R34 | ||
| 安全术语 | S:S1/2, S7/9, S26, S45 | ||
| NFPA 704 | |||
| 相关物质 | |||
| 其他阳离子 | 四氧化钌、二氧化锇 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
四氧化锇,又稱氧化锇(VIII),是化学式为OsO4的化合物,常溫下為無色固體,但大多數樣本呈現黃褐色[1],可能是由於其中存在棕黃色二氧化鋨(OsO2)雜質所致。[2]四氧化鋨具有一些不同於大多數金屬氧化物的特殊性質,例如具有揮發性和高毒性。
尽管四氧化锇有劇毒且锇元素罕見且昂貴,該化合物仍有很多用途,例如其與脂質結合的特性使其在生物學中廣泛用作電子顯微鏡樣本的染色劑。
物理性质
[编辑]纯四氧化锇是无色的,但因通常混有少量二氧化锇(OsO2)而呈黄褐色。OsO4可溶于四氯化碳(CCl4),微溶于水,与水反应生成锇酸(见下文)。OsO4具有挥发性,常温下易升华。气味与臭氧相似。锇的名称即起源于希腊文的“osme”,意思是“臭味”。[3]
| 溶剂 | 溶解度 | 温度(℃) |
|---|---|---|
| 水 | 7.24 | 25 |
| 四氯化碳 | 250 | 20 |
结构和电子排布
[编辑]锇(VIII)是d0金属離子,因此当Os(VIII)的配位数为四时,其形状应是四面体构型。还有MnO4−和CrO42−也是四面体构型。
OsO4中锇的化合价为+8,这是过渡金属的最高化合价。锇原子有8个价电子。如果假设每个Os-O键都提供两个电子,则该络合物总共有16个电子,与高锰酸根离子和铬酸根离子一样。
合成
[编辑]粉末状的锇在常温下与O2缓慢反应,生成OsO4。块状的锇则须加热至670 K才能被氧气氧化。[5]
- Os + 2 O2 → OsO4
反应
[编辑]氧氟化物
[编辑]- 锇有很多种氧氟化物,都对潮湿非常敏感。
在77K的低温下,四氧化锇与二氟化氪在氢氟酸溶液中反应,生成紫色的 顺式-OsO2F4。[6]
- OsO4 + 2 KrF2 → cis-OsO2F4 + 2 Kr + O2
- OsO4与F2反应,生成黄色的OsO3F2:
- 2 OsO4 + 2 F2 → 2 OsO3F2 + O2
- OsO4在常温下与等摩尔的[Me4N]F反应,在253K的温度下则与两倍的物质的量的[Me4N]F反应:[5]:
- OsO4 + [Me4N]F → [Me4N][OsO4F]
- OsO4 + 2 [Me4N]F → [Me4N]2[cis-OsO4F2]
烯烃的氧化
[编辑]- OsO4能催化烯烃与过氧化氢水溶液之间的反应。化学方程式为:
- R2C=CR2 + H2O2 → R2C(OH)-C(OH)R2.
反应中OsVIIIO4先与烯烃R2C=CR2发生加成反应,生成环"酯" R4C2O2OsVIO2,然后再水解,生成二醇和六价锇化合物(OsVI)[來源請求]:
其它反应
[编辑]- OsO4溶于碱溶液,生成高锇酸盐并分解得到锇(VI)酸盐:
- OsO4 + 2 NaOH → Na2[cis-OsO4(OH)2]
- Na2[cis-OsO4(OH)2]+H2O→Na2[OsO2(OH)4]+½O2
- OsO4 + NH3 + KOH → K[Os(N)O3] + 2 H2O
[Os(N)O3]−离子是OsO4的等电子体,且结构相同。与伯胺t-BuNH2[(CH3)3C-NH2]反应得到相应的亚氨基化合物:
- OsO4 + 4 Me3CNH2 → Os(NCMe3)4 + 4 H2O
- 在400K和200个大气压下,OsO4在甲醇溶液中与一氧化碳发生"还原性羰基化反应",生成三角形的Os3(CO)12:
此反应中锇的化合价从+8下降到0。
- 四氧化锇也可以被碳还原:
- OsO4 + 2 C → Os + 2 CO2[4]
用途
[编辑]有机合成
[编辑]
在有機合成領域中,OsO4广泛用作把烯烃顺式氧化成鄰二醇的氧化劑。参见以上反应机理。此反應既可以是催化反應(厄普約翰雙羥基化反應、勒米厄-约翰逊氧化反应),也可以是不對稱反應(夏普萊斯不對稱雙羥基化反應)。
生物染色
[编辑]OsO4由於含有重金屬鋨原子,對电子的阻擋性較佳,故廣泛用作穿透式電子顯微鏡組織標本的染劑,能增強影像的對比度。[8]OsO4的強氧化性使其能與未飽和碳-碳鍵反應,從而連接脂質。因此在染色的同時,它還會固定生物膜,從而使樣本結構特徵不被破壞,也能快速殺死原生動物等會移動的活體樣本。
鋨礦石精煉
[编辑]OsO4是從礦石中提取鋨的中間產物。將含鋨殘留物用過氧化鈉(Na2O2)處理,形成可溶的Na2[OsO4(OH)2]。該鹽與氯反應形成OsO4。在精煉的最後步驟,粗製的OsO4溶解在NaOH醇中形成Na2[OsO2(OH)4],用氯化銨(NH4Cl)處理後得到(NH4)4[OsO2Cl2]。將此鹽在氫氣中還原,即可得到鋨。[9]
藥物
[编辑]四氧化鋨唯一已知的臨床用途是治療關節炎。[10]由於缺乏有關局部施用四氧化鋨的長期副作用的報告,說明鋨本身可能具有生物相容性,儘管這取決於所施用的鋨化合物種類。2011年,有報告指出鋨(VI)[11]和鋨(II)[12]化合物在體內具抗癌活性,顯示使用鋨化合物作為抗癌藥物具有廣闊的前景。[13]
安全性
[编辑]
四氧化鋨的揮發性很高,能輕易穿透皮膚,且經吸入、進食和皮膚接觸後都是毒物。[14]如果空氣中含有低濃度四氧化鋨,會造成肺淤血及皮膚和眼部損害,人眼接觸四氧化鋨後會對角膜進行不可逆的染色,從而導致失明。因涉及四氧化鋨的實驗必須在通風櫃內操作。[15]四氧化鋨的容許暴露限值(8小時時間加權平均值)為2 µg/m3。[16]由於四氧化鋨可以穿透塑膠和食品包裝,因此必須在玻璃容器中冷藏保存。[17]
外部链接
[编辑]- 国际化学安全卡 0528(页面存档备份,存于互联网档案馆)
- NIOSH Pocket Guide to Chemical Hazards(页面存档备份,存于互联网档案馆)
- BBC report on bomb plot(页面存档备份,存于互联网档案馆)
- BBC 什么是四氧化锇(页面存档备份,存于互联网档案馆)
- 四氧化锇: 本月的化合物(页面存档备份,存于互联网档案馆)
- 化学反应(页面存档备份,存于互联网档案馆)
参考文献
[编辑]- ^ Girolami, Gregory. Osmium weighs. Nature Chemistry. 2012, 4 (11): 954. Bibcode:2012NatCh...4..954G. PMID 23089872. doi:10.1038/nchem.1479
 .
.
- ^ Cotton and Wilkinson, Advanced Inorganic Chemistry, p.1002
- ^ Dr. M Thomson, Osmium tetroxide (OsO4). [1] (页面存档备份,存于互联网档案馆)
- ^ 4.0 4.1 《无机化学丛书》.张青莲 主编.第九卷.P439. 3.2.2氧化物
- ^ 5.0 5.1 Housecroft & Sharpe. Inorganic Chemistry. (ed 2, 2005). p 671-673
- ^ Christe et al. "Osmium tetrafluoride dioxide, cis-OsO2F4". J. Am. Chem. Soc. 1993, 115. doi:11279-11284
- ^ Housecroft & Sharpe. Inorganic Chemistry. (ed 2, 2005). p 672,710
- ^ Bozzola, J. J.; Russell, L. D. Specimen Preparation for Transmission Electron Microscopy. Electron Microscopy: Principles and Techniques for Biologists. Sudbury, MA: Jones and Bartlett. 1999: 21–31. ISBN 978-0-7637-0192-5.
- ^ Thompson, M. Osmium tetroxide (OsO4). Bristol University. [2012-04-07]. (原始内容存档于2013-09-22).
- ^ Sheppeard, H.; D. J. Ward. Intra-articular osmic acid in rheumatoid arthritis: five years' experience. Rheumatology. 1980, 19 (1): 25–29. PMID 7361025. doi:10.1093/rheumatology/19.1.25.
- ^ Lau, T.-C; W.-X. Ni; W.-L. Man; M. T.-W. Cheung; et al. Osmium(vi) complexes as a new class of potential anti-cancer agents. Chem. Commun. 2011, 47 (7): 2140–2142. PMID 21203649. S2CID 1851467. doi:10.1039/C0CC04515B.
- ^ Sadler, Peter; Steve D. Shnyder; Ying Fu; Abraha Habtemariam; et al. Anti-colorectal cancer activity of an organometallic osmium arene azopyridine complex (PDF). Med. Chem. Commun. 2011, 2 (7): 666–668 [2023-11-06]. doi:10.1039/C1MD00075F. (原始内容存档 (PDF)于2023-07-15).
- ^ Fu, Ying; Romero, María J.; Habtemariam, Abraha; et al. The contrasting chemical reactivity of potent isoelectronic iminopyridine and azopyridine osmium(II) arene anticancer complexes (PDF). Chemical Science. 2012, 3 (8): 2485–2494 [2023-11-06]. doi:10.1039/C2SC20220D. (原始内容存档 (PDF)于2023-01-17).
- ^ Luttrell, William E.; Giles, Cory B. Toxic tips: Osmium tetroxide. Journal of Chemical Health and Safety. 2007, 14 (5): 40–41. doi:10.1016/j.jchas.2007.07.003.
- ^ Mager Stellman, J. Osmium. Encyclopaedia of Occupational Health and Safety. International Labour Organization. 1998: 63.34. ISBN 978-92-2-109816-4. OCLC 35279504.
- ^ Osmium tetroxide (as Os). Documentation for Immediately Dangerous to Life or Health Concentrations (IDLHs). Centers for Disease Control. 2 November 2018 [2023-11-06]. (原始内容存档于2023-05-30).
- ^ Hayat, M. A. Principles and Techniques of Electron Microscopy: Biological Applications. Cambridge University Press. 2000: 45–61. ISBN 0-521-63287-0.
- Cotton, S. A. "Chemistry of Precious Metals," Chapman and Hall (London): 1997. ISBN 0-7514-0413-6.
- Berrisford, D. J.; Bolm, C.; Sharpless, K. B., "Ligand Accelerated Catalysis", Angewandte Chemie, International Edition English, 1995, volume 34, pp. 1059-1070.
| |||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.