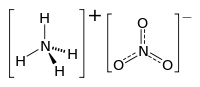
硝酸铵
| 硝酸铵 | |
|---|---|
| |
| |

| |
| IUPAC名 Ammonium nitrate | |
| 别名 | 硝铵、AN |
| 识别 | |
| CAS号 | 6484-52-2 |
| PubChem | 22985 |
| ChemSpider | 21511 |
| SMILES |
|
| InChI |
|
| InChIKey | DVARTQFDIMZBAA-IKLDFBCSAH |
| UN编号 | 0222 – with > 0.2% combustible substances 1942 – with <= 0.2% combustible substances 2067 – fertilizers 2426 – liquid |
| RTECS | BR9050000 |
| 性质 | |
| 化学式 | NH4NO3 |
| 摩尔质量 | 80.04336 g·mol⁻¹ |
| 外观 | 白色固体 |
| 密度 | 1.725 g/cm3(25 °C)[1] |
| 熔点 | 169.6 °C[1] |
| 沸点 | 约210°C时分解 |
| 溶解性(水) | 119 g/100 ml (0°C) 190 g/100 ml (20°C) 286 g/100 ml (40°C) 421 g/100 ml (60°C) 630 g/100 ml (80°C) 1024 g/100 ml (100°C) |
| 爆炸性 | |
| 撞击感度 | 50 cm (50 kg), 0% |
| 爆速 | 5,270 m/s |
| 危险性 | |
| 欧盟分类 | 未列明 |
| NFPA 704 | |
| 相关物质 | |
| 其他阴离子 | 亚硝酸铵、高氯酸铵 |
| 其他阳离子 | 硝酸钠、硝酸钾 硝酸羟胺 |
| 相关化学品 | 一氧化二氮 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
硝酸铵是一种化合物,是铵阳离子的硝酸盐。它的化学式是(简化为),是一种白色的结晶固体,在水中溶解度高。它在农业上主要作为高氮肥料使用。[2]其他用途是作为采矿、采石和土木建筑中使用的爆炸混合物的成分之一。它也是铵油炸药的主要成分,这是一种普遍的工业炸药,占北美炸药的80%。类似的配方也用于简易爆炸装置(IED,俗称土制炸弹)。由于担心有被误用的可能性,许多国家正把它从消费性应用中阶段性淘汰。[来源请求]
性质
物理性质
硝酸铵是无色斜方或单斜晶体,可溶于水、甲醇和乙醇。溶于水时能吸收大量热能而降低温度。
化学性质
硝酸铵遇热能够分解。
- 169 °C:
- 230 °C,反应迅速进行:
- 300 °C:
- 400 °C以上,反应极为猛烈:
反应生成
硝酸铵在智利最干旱的地区阿塔卡马沙漠被发现为天然矿物(硝石矿物例如硝酸钠),它通常是在地表层和/或与其他硝酸盐,氯酸盐,碘酸盐和卤化物矿物质结合一起。过去硝酸铵在那里开采,但现在使用的化学物质几乎都是是合成的。
生产
硝酸铵的工业化生产涉及氨与硝酸的酸碱反应:
合成方法:
氨以无水形式(即气体形式)使用,硝酸则是高浓度的。这种反应是剧烈的,由于其高放热性的物质本性。通常溶液形成后的浓度约为83%,剩余的水会依据等级不同,被蒸发成浓度95%至99.9%的硝酸铵(AN熔体)。然后将95%至99.9%的AN熔体在喷雾塔中制成“颗粒”或小珠,或者通过在旋转的滚筒中喷雾和翻滚而制成稍大颗粒。小颗粒或大颗粒都可以进一步干燥,冷却,然后包膜以防止结块。这些小或大颗粒是典型的AN商业产品。
该方法所需的氨可通过哈伯法(Haber process)从氮和氢获得。由哈伯法生产的氨再通过奥士华法(Ostwald process)可氧化成硝酸。另一种生产方法是变形的硝磷铵法(Odda process):
产物碳酸钙和硝酸铵可以纯化分离或者以钙化硝酸铵的形式出售。硝酸铵也可以通过复分解反应得到:
反应
硝酸铵可与金属氢氧化物反应,释放氨并形成金属硝酸盐:
- (M = Na,K等)
硝酸铵加热时不会有残留物:
硝酸铵也是可以由排放入大气中的NO、SO2和NH3化合形成,也是PM10的次要成分。
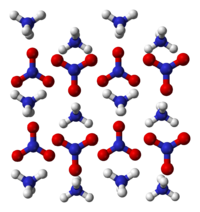
晶相
由于条件变化(例如温度,压力)导致的晶体状态的变化影响硝酸铵的物理性质。 下述结晶状态已被确认:[3]
| 晶系 | 温度 (°C) | 状态 | 体积变化 (%) |
| > 169.6 | 液体 | ||
| I | 169.6 to 125.2 | 立方(等轴)晶系 | -2.1 |
| II | 125.2 to 84.2 | 四方(正方)晶系 | +1.3 |
| III | 84.2 to 32.3 | α-斜方晶系 | -3.6 |
| IV | 32.3 to −16.8 | β-斜方晶系 | +2.9 |
| V | −16.8 | 四方(正方)晶系 |
第五(V)型晶体是与氯化铯相关的类立方形式,硝酸根阴离子的氮原子和铵阳离子的氮原子在晶格中的位置对应CsCl晶格中的Cs和Cl。
应用
肥料
硝酸铵是一种重要的肥料,NPK等级为34-0-0(34%氮)。 它的浓度低于尿素(46-0-0)[4],使硝酸铵在运输方面稍有劣势。硝酸铵比尿素的优势在于它更稳定,不会迅速向大气中损失氮。不过,硝酸铵是一种危险的物质,因为它具有高度爆炸性。因此,其制造和储存的规定非常严格,尤其是在欧盟。[5]根据法规,这些产品需要被检查与测试,并且技术文档必须证明产品的安全性。[6] 如果不加重视,则可能引发严重的安全事故,例如在贝鲁特发生的事故。
爆破
硝酸铵本身不是一种爆炸物,[7] 但当与主要爆炸物如叠氮化物或燃料如铝粉或燃料油组合时,它很容易形成具有不同性能的爆炸性混合物。
硝酸铵在敏感度方面而言是极其钝感的炸药,比安全炸药C4炸药更为钝感。一支工业8#雷管(起爆C4炸药只需要6#)都不足以起爆混合了敏化剂的硝酸铵。硝酸铵是最难引爆的硝酸炸药,撞击感度是:50kg锤50cm落高,0%爆炸。相比起著名炸药硝化甘油的200g锤,20cm落高,100%爆炸的感度,可见硝酸铵的钝感。而且硝酸铵一旦溶于水,起爆感度更是大大下降,人类根本不可能把它撞击引爆。
硝酸铵对高温的耐受力较差,分解温度一般大于或等于180度,但一般不会爆炸性分解。但当硝酸铵暴露于过高温度时便会有发生爆炸性分解的风险。
与燃油混合
肥料炸弹(ANFO)是94%硝酸铵(“AN”)和6%燃油(“FO”)的混合物,被广泛用作散装工业炸药。[8]:1ANFO低成本和易于使用的优点用于采煤、采石、金属开采等初阶应用,不论在耐水性、氧气平衡、高爆震速度和小直径性能等都比传统工业炸药更好。[8]
利基应用
因为硝酸铵在水中的溶解是高度吸热的,因此其使用于某些即溶冰敷袋上。它也被用于独立爆炸的“燃料”,如硝酸胍,[9][10]日本的安全气囊大厂高田公司制造的安全气囊的气体中使用硝酸铵作为5-氨基四唑的低成本(但不太稳定)替代品。因没有加入干燥剂,使得硝酸铵会因为久了之后受潮及高温而变质,当气囊作动时会因力道过大而使零件碎片飞散,反而造成车上驾驶及乘客因此受伤甚至死亡,并在造成14人死亡后因不安全被召回。[11]受影响的汽车品牌甚广,全球召回的车辆达上千万辆。[12]
硝酸铵除了工业用、军用炸药,及制作氮肥之外,也可用于制作杀虫剂、冷冻剂、氧化氮吸收剂、笑气、烟火等。
出口
根据Knoema网站的数据,2017年前5大出口国分别为俄罗斯、立陶宛、乔治亚、保加利亚和美国。但中国的出口数据未列入其中。[13]
安全、管理和储存
健康和安全数据记载在供应商提供的安全资料表上,在互联网上可以找到。[14]为了因应数起导致许多人死亡的爆炸,美国环境保护署(EPA),职业安全与健康管理局(OSHA)以及美国烟酒枪炮及爆裂物管理局(ATF) 联合颁布了安全准则。[15]
加热或任何点火源可能会引起剧烈的燃烧或爆炸。[16]硝酸铵可与可燃和还原材料反应,因为它是一种强氧化剂。虽然主要是用于肥料,但亦可用于爆炸物。有时候用来开凿土地做农场池塘。[17][18]硝酸铵也用于改变其他爆炸物的爆炸速度,例如把三硝基甲苯(TNT)转变成阿马托炸药(一种无烟炸药)。
硝酸铵的储存和处理有许多可行的安全准则。[19]硝酸铵不应该存放在易燃物质附近。硝酸铵与某些物质如氯酸盐,无机酸和金属硫化物不相容,接触会导致剧烈或甚至猛烈的分解。[20]
硝酸铵的临界相对湿度为59.4%,高于此值将吸收大气中的水分。因此,将硝酸铵储存在密封容器中是很重要的。否则它会吸湿结成块。硝酸铵可以吸收足够的水分液化。将硝酸铵与某些其他肥料混合可以降低临界相对湿度。[21]
这种材料有被作为爆炸物的潜在性,促使了监管措施。例如,在澳大利亚,“危险品条例”于2005年8月生效,以执行处理此类物质的许可。[22]许可证仅授予申请者(工业),并采取适当的安全措施,以防止任何滥用。[23]其他用途,如教育和研究目的可以考虑使用,但个人使用则不允许。有执照处理该物质的人员仍须经授权人员监督,并在执照获得许可前应该要通过安全和国家警察检查。
健康危害
根据健康和安全数据显示,在安全资料表中,硝酸铵可从供应商处获得,并可在互联网上找到。[24]
硝酸铵对健康并不十分有害,通常用于化肥产品。[24][25][26]
硝酸铵的半数致死剂量(LD50)为2217毫克/公斤(有毒物质的质量和试验生物体重比),[27]其比较约为食用盐的三分之二。
灾害
硝酸铵在加热时分解成一氧化二氮和水蒸气(不是爆炸性反应)。然而,它可以被爆炸引起热风分解。由于硝酸铵本身可提供燃烧所需氧气,所以大量储存的硝酸铵会有很高的火灾风险,而且也可能被引爆。
导致爆炸的两大主要类型是:
- 由于引爆机制的转变而产生爆炸。先是从一堆爆炸物中的炸药包起爆,接着由爆炸外壳射进易爆物引爆,或由爆炸混合物与一堆易爆物接触引爆。例子是Kriewald,Morgan(今日Sayreville,新泽西州),Oppau和Tessenderlo。
- 爆炸是由火灾蔓延到硝酸铵本身(德克萨斯城,布雷斯特,奥克代尔PA),或由火灾中的硝酸铵与可燃物的混合物(Repauno,切诺基,Nadadores)造成。火灾至少需要在一定的温度上,完成从燃烧到爆炸的转换(一种称为“爆燃到爆轰转变”的现象)。纯的、紧凑的硝酸铵(AN)是稳定的,很难点燃,并且许多情况下,甚至不稳定的AN都没有在火中爆炸。
硝酸铵引起的重大爆炸事故
- 德克萨斯城灾难:1947年4月16日清晨,一艘停泊于美国德克萨斯城的货轮Grand Camp号起火,引爆了船上的2300吨硝酸铵。爆炸还产生了连锁反应,导致附近的化工厂爆炸。冲天的大火直冲云霄,全城都能看见港口上升起的橙色浓烟。这次爆炸令大约600人死亡,3500多人受伤,被认为是美国历史上最严重的工业爆炸事故。
- 1963年1月9日,芬兰奥卢(Oulu)一家生产硝酸铵的化工厂发生爆炸,10人死亡。
- 1994年6月23日凌晨,天津市冶金局铝材厂在加温硝酸铵过程中,因未严格按照安全操作规程操作,致使池内的硝酸铵发生爆炸,与该厂相邻的大部分建筑物被摧毁,造成10人死亡,23人受伤。
- 1994年7月28日中午,四川蓬溪县某化肥厂由于管理不善,4名儿童混入了该厂硝酸铵库房背后,利用库房通风洞给灶炉点火烤鱼吃,结果火苗从通风洞引燃了百叶窗,紧接着又引燃了库房内的硝酸铵。致使147人中毒住院抢救,3人抢救无效死亡。
- 2001年9月21日,法国图卢兹AZF化工厂20-120吨硝酸铵发生爆炸,TNT当量为20-40吨,导致31人死亡,约2500人受伤。
- 朝鲜龙川火车站爆炸事件:发生于2004年4月22日,至少161人死亡,1300多人受伤。
- 天津港危化品仓库爆炸事故:发生于2015年,造成165人死亡。
- 贝鲁特爆炸事故:发生于2020年8月4日,造成至少220人以上死亡。[28]
参考文献
- ^ 1.0 1.1 "Hazardous Substances Data Bank" data were obtained from the National Library of Medicine (US). Retrieved from SciFinder. [2020-08-06]
- ^ Karl-Heinz Zapp "Ammonium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2012, Wiley-VCH, Weinheim. doi:10.1002/14356007.a02_243
- ^ Wolf, Friedrich; Scharre, W. Kinetics of ammonium nitrate polymorphic modification transformations NH4NO3(III)-> NH4NO3(IV) and NH4NO3(IV) NH4NO3(III). IV. Discussion of the influence of the modification transformation of III <-> IV of NH4NO3 on the caking of NH4NO3 and other mixtures containing it(德文). Zesz. Nauk. Uniw. Poznaniu, Mat., Fiz., Chem., 1967. 11. 66-75. ISSN: ZUPMAI.
- ^ Nutrient Content of Fertilizer Materials (PDF). [27 June 2012]. (原始内容 (PDF)存档于24 December 2012).
- ^ Safe and effective fertilisers on the EU market (from 2022). [16 December 2022]. (原始内容存档于2022-12-16).
- ^ EU FERTILISER PRODUCTS REGULATION. [16 December 2022]. (原始内容存档于2023-03-25).
- ^ Manhattan Bombs Provide Trove of Clues (页面存档备份,存于互联网档案馆) - The New York Times
- ^ 8.0 8.1 Cook, Melvin A. The Science of Industrial Explosives. IRECO Chemicals. 1974: 1. ASIN B0000EGDJT.
- ^ US 5531941
- ^ Airbag Compound Has Vexed Takata for Years (页面存档备份,存于互联网档案馆) - The New York Times
- ^ A Cheaper Airbag, and Takata’s Road to a Deadly Crisis. (页面存档备份,存于互联网档案馆) - The New York Times
- ^ 高田氣囊風暴 國內大規模召修28萬輛次. [2017-03-04]. (原始内容存档于2017-03-05).
- ^ Ammonium nitrate export - Ranking. knoema.com. [2020-08-09].
- ^ Ammonium nitrate MSDS. [2019-05-26]. (原始内容存档于2011-08-18).
- ^ Chemical Advisory: Safe Storage, Handling, and Management of Ammonium Nitrate (页面存档备份,存于互联网档案馆) United States Environmental Protection Agency
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill. 2002. ISBN 0-07-049439-8.
- ^ Pothole pond (PDF). [2019-05-26]. (原始内容存档 (PDF)于2016-03-04).
- ^ Progressive Farmer Magazine
- ^ Storing and handling ammonium nitrate (PDF). [2019-05-26]. (原始内容存档 (PDF)于2011-07-04).
- ^ Chemical Engineering Transactions 互联网档案馆的存档,存档日期2016-04-14.
- ^ Fertilizers Europe. Guidance for Compatibility of Fertilizer Blending Materials (PDF). 2006. (原始内容 (PDF)存档于2015-06-08).
- ^ Dangerous Goods (HCDG) Regulations (PDF). [2019-05-26]. (原始内容存档 (PDF)于2012-03-23).
- ^ Ammonium Nitrate-Regulating its use, Balancing Access & Protection from Worksafe Victoria. (原始内容存档于2011-03-11).
- ^ 24.0 24.1 CF Industries. Ammonium nitrate MSDS (PDF). (原始内容 (PDF)存档于2014-03-27).
- ^ Chemicalland21 – Ammonium Nitrate. (原始内容存档于2012-01-10).
- ^ Ammonium Nitrate. Paton Fertilizers Pty Ltd. 2005.
- ^ Material Safety Data Sheet, Ammonium nitrate MSDS. [2019-05-26]. (原始内容存档于2011-08-18).
- ^ 存档副本. [2020-08-05]. (原始内容存档于2021-11-29).
外部链接
- 国际化学品安全卡0216
- "Storing and Handling Ammonium Nitrate" (页面存档备份,存于互联网档案馆), United Kingdom Health and Safety Executive publication INDG230 (1986)
- Chemical Advisory: Safe Storage, Handling, and Management of Ammonium Nitrate (页面存档备份,存于互联网档案馆) United States Environmental Protection Agency
- Calculators: surface tensions (页面存档备份,存于互联网档案馆), and densities, molarities and molalities (页面存档备份,存于互联网档案馆) of aqueous ammonium nitrate铵化合物(NH₄⁺)
主族元素 过渡金属 复盐 有机酸盐 假想结构 氮化合物氢化物及其衍生物 氧化物 无机酸和盐 拟卤素 卤化物 含氮有机物 其它 各地 学术
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.





![{\displaystyle {\ce {5NH4NO3 ->[\Delta]4N2 (^) + 2HNO3 + 9H2O))}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0042134a86cf3cffc37578883039413ecd0f2e55)
![{\displaystyle {\ce {2NH4NO3 ->[\Delta] 4H2O + 2N2 (^) + O2 (^)))}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d679ed931d0b3b9ee4ad3a41886977e474937410)







