Ртуць
| ||||||
| Выгляд | ||||||
|---|---|---|---|---|---|---|

| ||||||
| Агульная інфармацыя | ||||||
| Назва, сымбаль, атамны нумар | Ртуць, Hg, 80 | |||||
| Катэгорыя элемэнту | Пераходныя мэталы | |||||
| Група, пэрыяд, блёк | 12, 6, d | |||||
| Адносная атамная маса | 200,59 г·моль−1 | |||||
| Канфігурацыя электронаў | [Xe] 4f14 5d10 6s2 | |||||
| Электронаў у абалонцы | 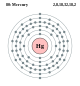
| |||||
| Фізычныя ўласьцівасьці | ||||||
| Тэмпэратура плаўленьня | –38,83 °C | |||||
| Тэмпэратура кіпеньня | 356,73 °C | |||||
| Крытычны пункт | 1750 K, 172,00 МПа | |||||
| Уласьцівасьці атама | ||||||
| Ступені затляненьня | +1, +2 | |||||
Ртуць, Жывое срэбра або Жывое серабро (па-лацінску: Hydrargyrum) Hg — хімічны элемэнт II групы пэрыядычнай сыстэмы; атамны нумар 80. Адзіны мэтал, які пры пакаёвай тэмпэратуры знаходзіцца ў вадкай фазе. Мае серабрысты колер. Вельмі цяжкі66-е месца сярод іншых элемэнтаў паводле распаўсюджанасьці. Рэдка сустракаецца ў прыродзе ў самародным стане. Асноўны рудны мінэрал ртуці — кінавар HgS. Атрымліваюць гэты мэтал награваньнем кінавары ў атмасфэры паветра і наступнай кандэнсацыі пароў. У параўнаньні зь іншымі мэталамі ртуць мае дастаткова нізкую целпаправоднасьць, і сярэднюю электраправоднасьць. Ртуць лёгка ўтварае стопкі з шматлікімі мэталамі, напрыклад золатам, срэбрам і цынай. Стопкі ртуці завуцца амальгамамі. Пары ртуці ўтвараюць злучэньні з нэонам, аргонам, крыптонам і ксэнонам пры электрычных разрадах. Гэтыя злучэньні ўтрымліваюцца сіламі Ван-дэр-Ваальса і адпавядаюць хімічным формулам HgNe, HgAr, HgKr і HgXe. Радовішчы ў Гішпаніі, Украіне, Расеі. Каля 75% ртуці вырабляецца ў Гішпаніі і Кітаі. Ёмістасьць для працы з ртуцьцю важыць 34,46 кг.
Выкарыстоўваецца ў прыборах вымярэньня ціску (баромэтры, маноматры, арэомэтры) і тэмпэратуры (тэрмомэтры). У электратэхніцы — у выключальніках, лямпах дзённага сьвятла, кварцавых лямпах. Лёгкасьць ўтварэньня амальгамы золата выкарыстоўваецца для выдзяленьня золата з ягоных руд. Іншыя прымяненьні — вытворчасьць пэстыцыдаў, ртутных кантэйнераў для вытворчасьці каустычнай соды і хлёру, зубных плёмбаў, фарбы устойлівай да марской вады, батарэек ды каталізатараў. Сярод солей ртуці найбольшае значэньне маюць хлярыд ртуці HgCl2 (для выдаленьня іржы), ртутнага хлярыду Hg2Cl2 (каламель, дагэтуль час ад часу выкарыстоўваецца ў мэдыцыне), фульмінат ртуці (Hg(ONC)2), дэтанатар, які шырока ўжываецца ў выбухоўках, і сульфід ртуці (HgS, кінавар, якасны пігмэнт для фарбаў). Важнае значэньне маюць арганічныя злучэньні ртуці.
Літаратура
[рэдагаваць | рэдагаваць крыніцу]- CRC Handbook of chemistry and physics / Editor-in-chief: David R. Lide. — 84th edition 2003-2004. — CRC press, 2003. — 2616 с. — ISBN 0849304849
Вонкавыя спасылкі
[рэдагаваць | рэдагаваць крыніцу]![]() Ртуць — сховішча мультымэдыйных матэрыялаў
Ртуць — сховішча мультымэдыйных матэрыялаў
- Mercury»the essentials (анг.) [WebElements Periodic Table]
Пэрыядычная сыстэма хімічных элемэнтаў Дз. І. Мендзялеева
| |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
