三羧酸循环

三羧酸循环(tricarboxylic acid cycle) 可简称为TCA cycle,亦作柠檬酸循环(citric acid cycle),是有氧呼吸的第二阶段。该循环以循环中一个重要中间体柠檬酸命名,又因为柠檬酸是一种三元羧酸,该反应又称为三羧酸循环。该循环亦因由英国生物化学家克雷布斯(Krebs)发现而称为克雷布斯循环(Krebs cycle),克雷布斯亦因此项贡献获1953年诺贝尔生理学或医学奖。丙酮酸在经过丙酮酸脱氢酶系氧化,生成乙酰辅酶A(acetyl-CoA)后,与四碳二元羧酸草酰乙酸化合,生成柠檬酸,进入柠檬酸循环。随后,经过一系列反应,两个碳原子转化为二氧化碳(CO2)分子,柠檬酸中蕴藏的化学能转化至还原的辅酶中。柠檬酸循环的终产物仍然是草酰乙酸,这使得该循环能源源不断地氧化输入循环的乙酰辅酶A。
一般情况下,柠檬酸循环产生的还原辅酶会连同糖酵解过程产生的还原辅酶一同,在氧化磷酸化过程中氧化,生成大量的ATP[1]:148。一分子的乙酰辅酶A在被柠檬酸循环代谢后,可产生两分子的CO2分子、三分子NADH、一分子FADH2,以及一分子GTP[注 1][2]:340。
柠檬酸循环可以代谢糖类、脂质,以及大部分氨基酸,因为这三类物质都能转换为乙酰辅酶A或柠檬酸循环的中间体,从而进入柠檬酸循环之中。另外,柠檬酸循环的许多中间体可供生物体利用。当中间产物不足时,可通过添补反应对中间产物进行补充。生物体最重要的填补反应是在丙酮酸羧化酶催化下,以一分子丙酮酸和一分子二氧化碳分子为原料,合成一分子草酰乙酸的反应[2]:343。
发现

1930年代,柠檬酸循环中的一些化学反应就已由阿尔伯特·圣捷尔吉阐明。阿尔伯特·圣捷尔吉因他对柠檬酸循环中的一个重要中间体延胡索酸的研究,而获得1937年诺贝尔生理学或医学奖[3]。柠檬酸循环本身则是由德国生物化学家汉斯·阿道夫·克雷布斯在1937年于锡菲大学发现的。他因对柠檬酸循环的研究而获得1953年诺贝尔生理医学奖[4]。
进化
构成柠檬酸循环的一些化学反应在厌氧细菌中就已出现了。柠檬酸循环本身则可能经过多次进化[5]。从理论上说,柠檬酸循环并不是没有相关的替代方案。然而,柠檬酸循环的效率却是最高的。即使存在进化上独立的能替代柠檬酸循环的过程,它们也应该已通过趋同演化而与柠檬酸循环融合[6][7]。
在有氧呼吸中的位置
|
参见:丙酮酸氧化 |
糖类在细胞质底物中发生糖酵解后,生成的终产物是丙酮酸。丙酮酸通过线粒体外膜上的通道蛋白,再通过线粒体内膜上的丙酮酸转位酶进入线粒体底物。之后,丙酮酸经丙酮酸脱氢酶复合体氧化,转化为可进入柠檬酸循环的乙酰辅酶A,这一过程称为丙酮酸氧化[2]:332。柠檬酸循环发生于线粒体底物中,但也有一部分会于线粒体内膜或嵴膜上发生。原核生物的柠檬酸循环则发生于细胞质底物中。柠檬酸循环产生的还原辅酶会在氧化磷酸化过程中与氧气反应,产生的能量会部分转移到ATP中[8]:368。
概述
柠檬酸循环是一个关键的代谢途径,它统一了碳水化合物、脂肪和蛋白质的代谢。
步骤
柠檬酸循环可概括为8大反应步骤[2]:335[8]:368:
第一步:柠檬酸合酶
|
主条目:柠檬酸合酶 |

柠檬酸合成酶催化乙酰辅酶A(Acetyl-CoA)与四碳的草酰乙酸(Oxaloacetate)发生缩合反应和硫酯水解,生成柠檬酸(Citrate),通常被视为循环的第一步。其四级结构由两个亚基组成,两个底物可以与每个亚基结合。[10]由于硫酯水解释放能量,反应是不可逆的。酶的活性位点激活乙酰辅酶A,使其类似于草酰乙酸的碳中心:沿着两个分子之间的键,硫酯基团(CoA)被水解,形成柠檬酸分子。[11]
该反应高度放能(ΔG°′ = -31.4 kJ/mol),也因此该步骤在标准条件下不可逆。此外,酶产生的柠檬酸能够竞争性抑制酶活性,尽管该反应非常有利(因为是放能的),但柠檬酸合酶可以受到严格调节。[11]例如,柠檬酸盐本身充当柠檬酸合成酶的抑制剂,而草酰乙酸与其结合会增加其对乙酰辅酶A的亲和力。这方面具有相当大的生物学重要性,因为它可以完全调节整个克雷布斯循环,使酶成为整个循环的“起搏器”。[12][13]糖酵解中的磷酸果糖激酶1会被柠檬酸盐抑制,同时它会激活乙酰辅酶 A 羧化酶以进行脂肪酸合成。这一点说明了我们代谢周期的相互关联性。[14]

第二步:乌头酸酶
|
主条目:乌头酸酶 |

柠檬酸在乌头酸酶(Aconitase)的催化作用下异构化通过生成乌头酸生成异柠檬酸(Isocitrate)。乌头酸酶可以催化顺乌头酸的水合反应及水合产物柠檬酸、异柠檬酸的脱水反应。虽然该反应是可逆的,但在pH=7.0,25摄氏度条件下,平衡混合物中柠檬酸和异柠檬酸的比例为9:1,因为异柠檬酸不断消耗,在克雷布斯循环中,由于质量作用定律,反应平衡不断右移。一旦产生了顺乌头酸,就添加水分子以将双键氧化成羟基,并通过添加水产生异柠檬酸。[16][17]
酶的活性位点有一个铁硫簇,可与一些极性氨基酸残基共同结合底物。丝氨酸、精氨酸、组氨酸和天冬氨酸残基确保与底物的结合,与(1R,2S)-柠檬酸盐单独特异性结合,排斥与其它形式的结合。[18][19][20]

第三步:异柠檬酸脱氢酶
|
主条目:异柠檬酸脱氢酶 |

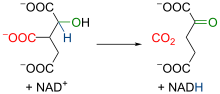
异柠檬酸在异柠檬酸脱氢酶(Isocitrate dehydrogenase)作用下,经中间体草酰琥珀酸(Oxalosuccinate)氧化脱羧生成α-酮戊二酸(α-Ketoglutarate)。线粒体异柠檬酸脱氢酶是一种依赖于NAD+和Mn2+、Mg2+存在的酶,在异柠檬酸转化为草酰琥珀酸的过程中,有一分子NAD+还原为NADH。[22][23]草酰琥珀酸具有β-酮酸的结构,与α位羧基的氧络合的二价离子的存在增加了该区域的电负性,导致分子电子重排,发生脱羧反应(即释放CO2分子),从而形成α-酮戊二酸,末端有两个羧基,和一个酮位于两个羧基之一的α位。该反应中,酶的活性要在Mg2+或Mn2+离子的辅助下才可实现。由于具有足够的放能(ΔG°' = -8.4 kJ/mol),能够将先前的反应从乌头酸酶向前推进。总的来说,该过程生成了一分子NADH以及一分子CO2。[24][25]
第四步:α-酮戊二酸脱氢酶
|
主条目:氧化戊二酸脱氢酶 |

异柠檬酸转化为α-酮戊二酸后,α-酮戊二酸在α-酮戊二酸脱氢酶复合体(α-Ketoglutarate dehydrogenase complex)的催化作用下,进行第二次氧化脱羧反应,与辅酶A化合,生成琥珀酰辅酶A(Succinyl-CoA),该过程还会生成一分子CO2,以及一分子NADH。该反应的机理与丙酮酸氧化机理相似,在生理条件下同样是一个单向反应。[27]两个反应都包括α-酮酸的脱羧以及随后与辅酶A生成高能硫酯键,催化这些反应的复合物彼此相似。[28]
α-酮戊二酸脱氢酶复合体由三种酶组成:α-酮戊二酸脱氢酶(E1)、二氢硫辛酰转琥珀酸酶(E2)、二氢硫辛酰脱氢酶(E3),α-酮戊二酸脱氢酶复合体要在一些辅助因子的辅助下才能发挥功能。该反应的自由能差为ΔG°′ = -30.1 kJ/mol,因此高度放能。[28]

第五步:琥珀酰辅酶A合成酶
|
主条目:琥珀酰辅酶A合成酶 |
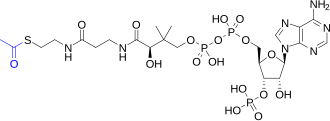
琥珀酰辅酶A是一种高能硫酯,其水解ΔG°′ = -33.5 kJ/mol,与ATP的-30.5 kJ/mol相似。柠檬酸合酶利用具有这种高能键的中间体来完成二碳分子(乙酰辅酶A)和四碳分子(草乙酸)之间的融合,而在琥珀酰辅酶A合成酶(Succinyl-CoA synthetase)利用这种能量来磷酸化。
来自硫酯的能量简单地转化为与磷酸键相连的能量:反应的第一步生成高能中间体磷酸琥珀酰,随后,催化位点中存在的组氨酸将磷酸盐从磷酸酯中去除。碳水化合物分子,生成产物琥珀酸和磷酸组氨酸分子,磷酸组氨酸分子迅速将磷酸盐转化为核苷二磷酸盐,将其“充电”为三磷酸盐。
琥珀酸辅酶A转化为琥珀酸(Succinate)和辅酶A,生成一分子GTP(该酶有两个版本,分别生成ATP和GTP;不同生物,或同一生物的不同组织会依对ATP和GTP需求的差异在该步使用相应版本的酶)。这是循环中在底物水平上发生磷酸化、生成高能磷酸键的唯一步骤。
接下来,琥珀酸经过三步反应,重新转化为草酰乙酸。

第六步:琥珀酸脱氢酶
|
主条目:琥珀酸脱氢酶 |

循环的最后部分是四碳分子的重新排列,直到草酰乙酸。为实现这一点,琥珀酸上存在的亚甲基桥必须转化为羰基,这种转化通过三个步骤发生:第一次氧化、水合和二次氧化。这三个步骤,除了再生草酰乙酸之外,还可以通过形成FADH2和NADH来提取更多能量。
第一个氧化反应是琥珀酸在琥珀酸脱氢酶(Succinate dehydrogenase)的催化作用下,转化为延胡索酸(Fumarate)。该过程中有一分子FAD还原为FADH2。琥珀酸脱氢酶复合物是循环中唯一以FAD而不是NAD+作为氢受体的酶,FAD通过组氨酸残基与酶共价连接。该酶使用FAD,因为与反应相关的能量不足以还原 NAD+。

第七步:延胡索酸
|
主条目:延胡索酸酶 |

延胡索酸经延胡索酸酶(Fumarase)催化,催化水分子中的H+和OH-基团加成到反式分子上,由于该酶只能在一侧结合 OH-,转化为L-苹果酸(L-Malate)。
延胡索酶有两类:I类和II类,取决于其相关亚基的排列、对金属的需求及其热稳定性。I类延胡索酸酶在受热或辐射时能够改变状态或变得失活,对超氧阴离子敏感,依赖Fe2+,是二聚体,约120 kD。II类延胡索酸酶存在于原核生物和真核生物中,是 20 kD的四聚酶,包含三个不同的显着同源的氨基酸片段,并且不依赖铁且热稳定。已知原核生物具有三种不同形式的延胡索酸酶:延胡索酸酶A、延胡索酸酶B和延胡索酸酶C,后者属于II类延胡索酶,而延胡索酸酶A和延胡索酸酶B被归类为I类。[32][33]

第八步:苹果酸脱氢酶
|
主条目:苹果酸脱氢酶 |

L-苹果酸在苹果酸脱氢酶(Malate dehydrogenase)的催化作用下,转化为草酰乙酸。该过程生成一分子NADH。
与最后一个反应相关的吉布斯自由能显然是正的(与循环中的其他反应不同)。该酶的活性是由柠檬酸合酶消耗草酰乙酸和电子传递链消耗NADH 驱动。该反应平衡倾向于苹果酸一侧,但因草酰乙酸不断消耗,反应得以持续进行。基于上述理由,该反应也是柠檬酸循环的一个重要调控位点[1]:149。
至此,柠檬酸循环完成。生成的草酰乙酸可再次进入柠檬酸循环[2]:335。

添补反应
|
主条目:添补反应 |
|
参见:乙醛酸循环 |
三羧酸循环的中间产物可能会因参与其他代谢过程而消耗,添补反应(Anaplerotic reactions)能够补充柠檬酸循环的各中间产物.使得其物质量保持相对平衡[35]。添补反应中最重要的一个是在丙酮酸羧化酶催化下,以一分子丙酮酸和一分子二氧化碳分子为原料,合成一分子草酰乙酸的反应。而在植物体内,乙醛酸循环能起到同样的作用[2]:343。另外,乳酸可以先氧化为丙酮酸,然后再通过羧化反应转化为草酰乙酸进入柠檬酸循环[1]:152。
总反应式
高等动物的柠檬酸循环可用下式表示:[2]:340
乙酰辅酶A+3 NAD+ + FAD + GDP + Pi + 2 H2O →
辅酶A-SH + 3 NADH + 3 H+ + FADH2 + GTP + 2 CO2
调控及抑制
调控
多种途径均可调控柠檬酸循环的进行。总的来说,当细胞供能充足时(ATP、NADH、乙酰辅酶A等物质浓度升高),柠檬酸循环速度较慢,而当细胞供能处于不足状态时(ADP浓度高,ATP、NADH浓度低),柠檬酸循环的速度会加快,保证能为生物体提供适量的ATP以及还原辅酶[8]:370。
首先,因为柠檬酸循环是呼吸作用的一个环节,对下游的电子传递链、氧化磷酸化进行调控即可对柠檬酸循环起到调控作用。对柠檬酸循环上游的丙酮酸氧化进行调控也可以起调控柠檬酸活性的作用。另外,也可以通过调控柠檬酸循环中的酶的活性起调控柠檬酸循环的作用。从化学原理上讲,对能进行得较彻底的反应进行调控效果较好,因此,丙酮酸脱氢酶、柠檬酸合成酶、异柠檬酸脱氢酶、α-酮戊二酸脱氢酶是较好的调控位点。对柠檬酸循环的调控通常来说与细胞的状态有密切关系。比如,脱氢酶需要钙离子的激活,而肌肉收缩时,胞内的钙离子浓度会升高,这也正是需能较高的时候。此外,一些酶也能直接和ATP/ADP,或NADH/NAD+反应,并发生活性变化,比如异柠檬酸脱氢酶能经由ADP激活,也可透过ATP/NADH来抑制。苹果酸脱氢酶的活性受NAD+/NADH比值的影响。此外,柠檬酸循环的中间体的浓度也可以对柠檬酸循环的活性起到调控作用。比如,草酰乙酸可以抑制琥珀酰脱氢酶的活性。不过,这类调控在体内到底发挥多大的作用,目前还未得到充分研究。[1]:153[2]:342
抑制
部分物质可以通过化学作用抑制柠檬酸循环的进行,其中,以下三种物质研究得较透彻:氟乙酸、亚砷酸、丙二酸[1]:151。
其中,氟乙酸通过生成氟乙酰辅酶A,再生成氟代乙酰辅酶A进而生成氟柠檬酸。氟柠檬酸能抑制乌头酸酶的活性,使得柠檬酸循环无法继续进行。利用这一原理,可以用氟乙酸制造杀虫剂或灭鼠药。[2]:337亚砷酸能抑制α-酮戊二酸脱氢酶复合体的酶活性[1]:149。丙二酸与琥珀酸脱氢酶的底物琥珀酸结构相似,能通过与该酶发生不可逆结合使其失活[2]:339。
此外,该途径关键的限速酶柠檬酸合酶受ATP、NADH、琥珀酰CoA的抑制。异柠檬酸脱氢酶受ATP的抑制。α-酮戊二酸脱氢酶系受ATP和琥珀酰CoA的抑制。
与其他代谢过程的关系
柠檬酸循环与包括脂肪酸合成、糖发育不良、转氨基作用、嘌呤和嘧啶的合成等在内的多种生物体内的代谢过程密切相关[8]:371。
糖发育不良及转氨基作用
在人的肝、肾中,柠檬酸循环中的草酰乙酸可通过糖异生作用转化为葡萄糖。在糖异生作用中,最关键的酶是磷酸丙酮酸羧基激酶,它可以使草酰乙酸脱羧,生成磷酸丙酮酸,GTP分子为该反应提供能量。值得注意的是,琥珀酰辅酶A转化为琥珀酸过程中生成的GTP分子可用于上述过程,是一个糖发育不良与柠檬酸循环联系的纽带[1]:150。
柠檬酸循环的一些中间体可通过转氨基作用,经过一系列反应转化为氨基酸。比如,α-酮戊二酸可以转化为谷氨酸,草酰乙酸可以转化为天冬氨酸。上述过程是可逆的,即氨基酸也可以通过脱氨基作用转化为柠檬酸循环的中间体而进入柠檬酸循环分解代谢。不过,氨基酸通过上述途径分解代谢产生的能量很少,一般情况下,只占生物体总产能的1%不到[2]:438。
脂肪酸合成
|
主条目:脂肪酸合成 |
在非反刍动物体内,细胞质底物中发生的长链脂肪酸合成以乙酰辅酶A为主要原料。但丙酮酸氧化生成的乙酰辅酶A却位于线粒体底物内,且乙酰辅酶A是无法穿过线粒体膜的。不过,在乌头酸酶与底物的结合处于饱和状态的条件下,线粒体底物中的柠檬酸可转运到细胞质底物中。细胞质底物中的ATP-柠檬酸裂合酶可将柠檬酸裂解为乙酰辅酶A以及草酰乙酸。后者即可用于脂肪酸合成过程。这样的机制也能保证只有当柠檬酸循环的强度达到一定强度的条件下,柠檬酸才可以用于脂肪酸合成[1]:153。另外,输入线粒体的脂肪酸(脂肪的消化产物)也能通过转化为乙酰辅酶A进入循环[36]:448。
卟啉合成
另外,琥珀酰辅酶A亦是卟啉环合成的重要中间体,卟啉中大部分的碳原子都来自琥珀酰辅酶A。卟啉是血红素蛋白(包括血红蛋白、肌红蛋白和细胞色素等)的重要组成成分[8]:371[37]。
参见
注释
参考文献
- ^ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 Robert K. Murray et al. Haper's Illustrated Biochemistry(哈珀生物化學) (導讀本). 科学出版社. 2010. ISBN 978-7-03-028539-3.
- ^ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 王镜岩、朱圣庚、徐长法. 生物化學教程. 高等教育出版社. 2008. ISBN 978-7-04-018363-4.
- ^ The Nobel Prize in Physiology or Medicine 1937. The Nobel Foundation. [2011-10-26]. (原始内容存档于2007-02-19).
- ^ The Nobel Prize in Physiology or Medicine 1953. The Nobel Foundation. [2011-10-26]. (原始内容存档于2007-02-22).
- ^ Gest H. Evolutionary roots of the citric acid cycle in prokaryotes. Biochem. Soc. Symp. 1987, 54: 3–16. PMID 3332996.
- ^ Meléndez-Hevia E, Waddell TG, Cascante M. The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution. J. Mol. Evol. September 1996, 43 (3): 293–303. PMID 8703096. doi:10.1007/BF02338838.
- ^ Ebenhöh O, Heinrich R. Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems. Bull. Math. Biol. January 2001, 63 (1): 21–55. PMID 11146883. doi:10.1006/bulm.2000.0197.
- ^ 8.0 8.1 8.2 8.3 8.4 David Hames, Nigel Hooper. Instant Notes in Biochemistry (3rd edition) 精要速覽系列:生物化學. 科学出版社. 2005. ISBN 978-7-03-025218-0 (英语).
- ^ Template:Cita pubblicazione
- ^ Wiegand, Georg; Remington, Stephen J. CITRATE SYNTHASE: Structure, Control, and Mechanism. Annual Review of Biophysics and Biophysical Chemistry. 1986-06, 15 (1) [2024-01-21]. ISSN 0883-9182. doi:10.1146/annurev.bb.15.060186.000525. (原始内容存档于2022-11-08) (英语).
- ^ 11.0 11.1 Condon, R. Erasmus: Paradigm of Renaissance Humanism Stanley R. Friesen, Padova, Piccin Nuova Libraria, 2001, 164 pages.. Journal of Gastrointestinal Surgery. 2002-08, 6 (4). ISSN 1091-255X. doi:10.1016/s1091-255x(02)00020-3.
- ^ Wiegand, Georg; Remington, Stephen J. CITRATE SYNTHASE: Structure, Control, and Mechanism. Annual Review of Biophysics and Biophysical Chemistry. 1986-06, 15 (1) [2024-01-21]. ISSN 0883-9182. doi:10.1146/annurev.bb.15.060186.000525. (原始内容存档于2022-11-08) (英语).
- ^ MacDonald, Michael J; Al-Masri, Hussam; Jumelle-Laclau, Muriel; Cruz, Meredith O. Oscillations in Activities of Enzymes in Pancreatic Islet Subcellular Fractions Induced by Physiological Concentrations of Effectors. Diabetes. 1997-12-01, 46 (12). ISSN 0012-1797. doi:10.2337/diab.46.12.1996.
- ^ Bordoni, Bruno; Simonelli, Marta; Morabito, Bruno. The Fascial Breath. Cureus. 2019-07-23. ISSN 2168-8184. doi:10.7759/cureus.5208.
- ^ Lauble, Hanspeter; Stout, Charles David. Steric and conformational features of the aconitase mechanism. Proteins: Structure, Function, and Bioinformatics. 1995-05, 22 (1). ISSN 0887-3585. doi:10.1002/prot.340220102 (英语).
- ^ Olsen, Luke; Hassan, Huzaifa; Xia, Fanning; Keaton, Sarah; Rohner, Nicolas. Cavefish mount a rapid and sustained regenerative response following skeletal muscle injury. Zoological Research. 2023, 44 (4). ISSN 2095-8137. doi:10.24272/j.issn.2095-8137.2022.486.
- ^ M. DE PANFILIS; L. MARCELLI. Il periodo sismico della Sicilia occidentale iniziato il 14 Gennaio 1968. Annals of Geophysics. 2011-05-09, 21 (4). ISSN 2037-416X. doi:10.4401/ag-5072.
- ^ Condon, R. Erasmus: Paradigm of Renaissance Humanism Stanley R. Friesen, Padova, Piccin Nuova Libraria, 2001, 164 pages.. Journal of Gastrointestinal Surgery. 2002-08, 6 (4). ISSN 1091-255X. doi:10.1016/s1091-255x(02)00020-3.
- ^ Robbins, A. H.; Stout, C. D. The structure of aconitase. Proteins: Structure, Function, and Bioinformatics. 1989-01, 5 (4) [2024-01-21]. ISSN 0887-3585. doi:10.1002/prot.340050406. (原始内容存档于2023-02-11) (英语).
- ^ Beinert, Helmut; Kennedy, Mary Claire. Aconitase, a two‐faced protein: enzyme and iron regulatory factor. The FASEB Journal. 1993-12, 7 (15). ISSN 0892-6638. doi:10.1096/fasebj.7.15.8262329.
- ^ Stoddard, B.L.; Mesecar, A.; Koshland Junior, D.E. ORBITAL STEERING IN THE CATALYTIC POWER OF ENZYMES: SMALL STRUCTURAL CHANGES WITH LARGE CATALYTIC CONSEQUENCES. dx.doi.org. 1997-11-12 [2024-01-21].
- ^ Schowen, Richard L. Principles of biochemistry 2nd ed. (Lehninger, Albert L.; Nelson, David L.; Cox, Michael M.). Journal of Chemical Education. 1993-08, 70 (8) [2024-01-21]. ISSN 0021-9584. doi:10.1021/ed070pa223.1. (原始内容存档于2023-04-19).
- ^ Yasutake, Yoshiaki; Watanabe, Seiya; Yao, Min; Takada, Yasuhiro; Fukunaga, Noriyuki; Tanaka, Isao. Crystal Structure of the Monomeric Isocitrate Dehydrogenase in the Presence of NADP+. Journal of Biological Chemistry. 2003-09, 278 (38) [2024-01-21]. doi:10.1074/jbc.M304091200. (原始内容存档于2024-06-04) (英语).
- ^ Carlo di Giuliano di Filippo. Benezit Dictionary of Artists. Oxford University Press http://dx.doi.org/10.1093/benz/9780199773787.article.b00032269. 2011-10-31. 缺少或
|title=为空 (帮助) - ^ Condon, R. Erasmus: Paradigm of Renaissance Humanism Stanley R. Friesen, Padova, Piccin Nuova Libraria, 2001, 164 pages.. Journal of Gastrointestinal Surgery. 2002-08, 6 (4). ISSN 1091-255X. doi:10.1016/s1091-255x(02)00020-3.
- ^ Knapp, James E.; Carroll, Donald; Lawson, Janet E.; Ernst, Stephen R.; Reed, Lester J.; Hackert, Marvin L. Expression, purification, and structural analysis of the trimeric form of the catalytic domain of the Escherichia coli dihydrolipoamide succinyltransferase. Protein Science. 2000-01, 9 (1). ISSN 0961-8368. PMC 2144448
 . PMID 10739245. doi:10.1110/ps.9.1.37 (英语).
. PMID 10739245. doi:10.1110/ps.9.1.37 (英语).
- ^ Condon, R. Erasmus: Paradigm of Renaissance Humanism Stanley R. Friesen, Padova, Piccin Nuova Libraria, 2001, 164 pages.. Journal of Gastrointestinal Surgery. 2002-08, 6 (4). ISSN 1091-255X. doi:10.1016/s1091-255x(02)00020-3.
- ^ 28.0 28.1 Voet, Judith G.; Voet, Donald. Editorial. Biochemical Education. 2000-05, 28 (3). ISSN 0307-4412. doi:10.1111/j.1539-3429.2000.tb00041.x.
- ^ Fraser, Marie E.; James, Michael N.G.; Bridger, William A.; Wolodko, William T. Phosphorylated and dephosphorylated structures of pig heart, GTP-specific succinyl-CoA synthetase. Journal of Molecular Biology. 2000-06, 299 (5). doi:10.1006/jmbi.2000.3807 (英语).
- ^ Oyedotun, Kayode S.; Lemire, Bernard D. The Quaternary Structure of the Saccharomyces cerevisiae Succinate Dehydrogenase. Journal of Biological Chemistry. 2004-03, 279 (10). doi:10.1074/jbc.M311876200 (英语).
- ^ Estévez, Marcel; Skarda, Jeremy; Spencer, Josh; Banaszak, Leonard; Weaver, Todd M. X‐ray crystallographic and kinetic correlation of a clinically observed human fumarase mutation. Protein Science. 2002-06, 11 (6). ISSN 0961-8368. PMC 2373640
 . PMID 12021453. doi:10.1110/ps.0201502 (英语).
. PMID 12021453. doi:10.1110/ps.0201502 (英语).
- ^ Lynch, AM; Morton, CC. FH (fumarate hydratase). Atlas of Genetics and Cytogenetics in Oncology and Haematology. 2011-02, (4). ISSN 1768-3262. doi:10.4267/2042/38351.
- ^ Estévez, Marcel; Skarda, Jeremy; Spencer, Josh; Banaszak, Leonard; Weaver, Todd M. X‐ray crystallographic and kinetic correlation of a clinically observed human fumarase mutation. Protein Science. 2002-06, 11 (6) [2024-01-21]. ISSN 0961-8368. PMC 2373640
 . PMID 12021453. doi:10.1110/ps.0201502. (原始内容存档于2023-12-16) (英语).
. PMID 12021453. doi:10.1110/ps.0201502. (原始内容存档于2023-12-16) (英语).
- ^ Nishiyama, M.; Birktoft, J.J.; Beppu, T. Alteration of coenzyme specificity of malate dehydrogenase from Thermus flavus by site-directed mutagenesis.. Journal of Biological Chemistry. 1993-03, 268 (7). ISSN 0021-9258. doi:10.1016/s0021-9258(18)53446-3.
- ^ Owen O, Kalhan S, Hanson R. The key role of anaplerosis and cataplerosis for citric acid cycle function. J. Biol. Chem. 2002, 277 (34): 30409–12 [2016-08-05]. PMID 12087111. doi:10.1074/jbc.R200006200. (原始内容存档于2008-11-06).
- ^ B. Alberts等著 丁小燕、陈跃磊等译. 細胞生物學精要(Essential Cell Biology)第三版(中譯本). 科学出版社. 2012. ISBN 978-7-03-033015-4.
- ^ Stryer, Lubert. Citric acid cycle.. In: Biochemistry. Fourth. New York: W.H. Freeman and Company. 1995: 509–527, 569–579, 614–616, 638–641, 732–735, 739–748, 770–7731995. ISBN 0 7167 2009 4.
外部链接
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 三羧酸循环代谢途径 | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 草酰乙酸 | 苹果酸 | 延胡索酸 | 琥珀酸 | 琥珀酰辅酶A | ||||||||||||
| 乙酰辅酶A | NADH + H+ | NAD+ | H2O | FADH2 | FAD | 辅酶A + ATP(GTP) | Pi + ADP(GDP) | |||||||||
| + | H2O | NADH + H+ + CO2 | ||||||||||||||
| 辅酶A | NAD+ | |||||||||||||||
| H2O | H2O | NAD(P)+ | NAD(P)H + H+ | CO2 | ||||||||||||
| 柠檬酸 | 顺乌头酸 | 异柠檬酸 | 草酰琥珀酸 | α-酮戊二酸 | ||||||||||||
| |||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.


