Lantaanoksied
|
Algemeen | |
|---|---|
| Naam | Lantaanoksied |
 |
 |
| Chemiese formule | La2O3 |
| Molêre massa | 325,82 [g/mol][1] |
| CAS-nommer | 1312-81-8[1] |
| Voorkoms | wit vastestof[1] |
| Reuk | reukloos[1] |
| Fasegedrag | |
| Fase | T<2313K |
| Selkonstantes | a=393,8; c=613,6 pm[2] |
| Ruimtegroep | P3m1 |
| Nommer | 164 |
| Strukturbericht | D5₂ |
| Fase | 2373K>T>2313K |
| Ruimtegroep | P63/mmc |
| Nommer | 194 |
| Fase | T>2373K |
| Ruimtegroep | Im3m |
| Nommer | 229 |
| Smeltpunt | 2 315 °C [1] |
| Kookpunt | 4 200 °C [1] |
| Digtheid | |
| Oplosbaarheid | onoplosbaar; reageer met water[1] |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | |
| LD50 | >5 000 [mg/kg][3] |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Lantaanoksied is 'n verbinding van lantaan en suurstof met die chemiese formule La2O3.
Die stof is higroskopies.[1]
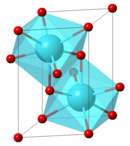
Kristalstruktuur
Lantaanoksied kristalliseer in 'n trigonale struktuur wat die argetipe is van die D52-struktuur van die strukturbericht-klassifikasie. Daar is heelparty oksiede van ander seldsame aarde en 'n aantal metaallegerings wat hierdie struktuur besit, soos: α-Bi2Mg3, α-Sb2Mg3, Ac2O3, As2Mg3, Ce2O3, Gd2O3, Nd2O3, Pr2O3, Pu2O3, Th2N3 en U2N3.[2]
Hierdie struktuur word ook die A-tipe seskwioksied (A-Ln2O3-tipe) genoem. (Sien: lantaniedoksiede). Die metaalione het 'n ongewone sewevoudige koördinasie deur suurstofione. Lantaanoksied kan met ander oksiede mengkristalle vorm soos die reeks La2−xEuxO3 (x<0,1) wat ook as La2O3:Eu weergegee word. Hierdie gedoteerde vorms het luminesserende eienskappe.[4]
Teen hoë temperature vind twee faseoorgange plaas. Teen 2313K skakel die struktuur om na die heksagonale H-tipe Ln2O3-struktuur en teen 2373K na die X-tipe-struktuur.[5]
Daar is berig dat die stabiele laetemperatuurfase eintlik die C-tipe sou wees, wat teen 500 °C na die A-tipe oorgaan, maar die materiale wat hierdie oorgang vertoon, bevat nog vlugtige komponente. Die C-tipe-struktuur word dalk deur OH−-ione gestabiliseer en hierdie materiale is nie suiwer oksiede nie.[5]
Chemiese eienskappe
Lantaanoksied kan uit die elemente vervaardig word:[6]
Die oksied kan nes kalsiumoksied in water geblus word, wat baie hitte vrystel:
Lantaanoksied kan gebruik word om lantaanfluoried te verkry:[4]
Die ammoniumfluoorlantanaat NH4LaF4 kan teen hoër temperature ontbind word:
Verwysings
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 "Safety Data Sheet". Fisher. Besoek op 11 November 2023.
- ↑ 2,0 2,1 "La2O3 (D52) Structure: A2B3_hP5_164_d_ad". Aflow.
- ↑ Charles E. Lambert, Marie Laure Ledrich (2024). Lanthanide series of metals; In: Encyclopedia of Toxicology (Fourth Edition). Academic Press. pp. 783–790. doi:10.1016/B978-0-12-824315-2.00129-9. ISBN 9780323854344.
((cite book)): Onbekende parameter|editors=geïgnoreer (hulp)AS1-onderhoud: gebruik authors-parameter (link) - ↑ 4,0 4,1 Meyer, Hans-Jürgen. (2023). "2 Festkörperchemie"; In: Riedel Moderne Anorganische Chemie. Berlin, Boston: De Gruyter. pp. 183–428. doi:10.1515/9783110790221-002.
((cite book)): Onbekende parameter|editors=geïgnoreer (hulp)AS1-onderhoud: gebruik authors-parameter (link) - ↑ 5,0 5,1 Matvei Zinkevich (2007). "Thermodynamics of rare earth sesquioxides". Progress in Materials Science. 52: 597–647.
((cite journal)): AS1-onderhoud: gebruik authors-parameter (link) - ↑ Richard P. Wedeen, Balazs Berlinger, Jan Aaseth (2015). Chapter 42 - Lanthanum; In:Handbook on the Toxicology of Metals (Fourth Edition). Academic Press. pp. 903–909. doi:10.1016/B978-0-444-59453-2.00042-1. ISBN 9780444594532.
((cite book)): Onbekende parameter|editors=geïgnoreer (hulp)AS1-onderhoud: gebruik authors-parameter (link)
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.




