氢化铝
| 氢化铝 | |
|---|---|
| |
| IUPAC名 aluminium trihydride alumane trihydridoaluminium | |
| 别名 | Aluminium(III) hydride Alane |
| 识别 | |
| CAS号 | 7784-21-6 ? |
| PubChem | 14488 |
| ChemSpider | 13833 |
| SMILES |
|
| InChI |
|
| InChIKey | AZDRQVAHHNSJOQ-FSBNLZEDAV |
| 性质 | |
| 化学式 | AlH3 |
| 摩尔质量 | 29.99 g·mol⁻¹ |
| 外观 | 无色至白色晶体,易挥发,高聚合度,针状 |
| 密度 | 1.486 g/cm3,固体 |
| 熔点 | 150 °C |
| 沸点 | 分解 |
| 溶解性(水) | 反应 |
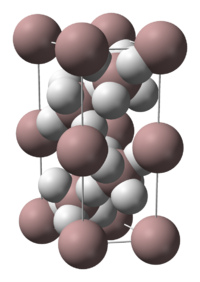
| 结构 | |
| 晶体结构 | 六方晶系 |
| 相关物质 | |
| 相关化学品 | 氢化铝锂 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
氢化铝(AlH3)是铝的氢化物。用作还原剂。用于炔烃的铝氢化反应、烯丙重排反应以及氢燃料汽车中氢气的储存。[1][2]
氢化铝是无色的聚合结构固体((AlH3)n)。
历史
[编辑]氢化铝最早是以杂质或胺/醚络合物的形式得到。[3]直到1947年,芝加哥大学的 Finholt 等才首次制得纯的氢化铝。[4]
结构与物理性质
[编辑]氢化铝有多种晶型,较为常见的有 α-、α'-、β-、δ-、ε-、θ- 和 γ-型。α-氢化铝为立方或菱方结构,每个 Al 原子被6个 H 原子包围,每个 H 原子再各自与另外一个 Al 原子桥连;Al-H 键长均为 172 pm,Al-H-Al 角为 141°。[5]α'-型氢化铝则为针状结晶。
氢化铝可溶于四氢呋喃和醚。
 |
 |
 |
氢化铝分子
[编辑]AlH3单体已在低温的固体惰性气体基质中分离,结构为平面型分子,很不稳定。[6]它的二聚体Al2H6已在固态氢中分离。它的结构和乙硼烷(B2H6)以及乙镓烷(Ga2H6)一样。[7][8]
化学性质
[编辑]α-氢化铝为热稳定性最高的晶型。
β- 和 γ-型氢化铝通常会共同生成,并且在加热时会转变为 α-氢化铝。δ-、ε- 和 θ-氢化铝则在不同的结晶条件下生成;虽然其稳定性不及 α-变体,但加热时并不会发生晶型转变。[9]
AlH3 可与强路易斯碱很快形成加合物。例如它可与三甲胺形成 1:1 和 1:2 两种加合物。1:1加合物在气相是四面体型结构,[10]在固态则为含有氢桥的二聚结构——(NMe3Al(μ-H))2。[11]1:2加合物为三角双锥结构。[10]
某些加合物如乙基二甲基胺-氢化铝(NMe2Et.AlH3)可遇热分解为金属铝,可能在有机金属化学气相沉积有潜在的应用。[12]
制取
[编辑]氢化铝一般是通过用氢化铝锂的醚溶液与三氯化铝作用而制得。反应后得到的是氢化铝的醚溶液。另一个产物氯化锂则沉淀出来。反应时一般需要加入 0.5-4 mol 的硼氢化物以助于三氯化铝的溶解。硼氢化物的价格较贵,并且反应后不能回收,从而增加了氢化铝的制取成本。[1]
- 3 LiAlH4 + AlCl3 → 4 AlH3 + 3 LiCl
氢化铝的醚溶液需要现制现用,否则 AlH3 与醚形成的聚合物会与 AlH3 一同沉淀出来。AlH3 溶液通常会在制备3日后变质。
AlH3 活性高于氢化铝锂。它在使用时的注意事项与氢化铝锂相似。[9]相关实验需在通风橱中进行。[9]
此外还可通过如下方法制取氢化铝:
- 2 LiAlH4 + BeCl2 → 2 AlH3 + LiBeH2Cl2
- 2 LiAlH4 + H2SO4 → 2 AlH3 + Li2SO4 + 2 H2[來源請求]
- 2 LiAlH4 + ZnCl2 → 2 AlH3 + 2 LiCl + ZnH2
用途
[编辑]还原剂
[编辑]氢化铝在有机合成中最常用的用途是作为还原剂,它在很多方面与氢化铝锂都很相似。它可将醛、酮、羧酸、酸酐、酰氯、酯和内酯分别还原为相应的醇。与酰胺、腈和肟作用时,则可将其还原为相应的胺。
氢化铝在反应选择性方面与其他氢化物还原剂有所不同。例如,在如下环己酮衍生物的还原反应中,用氢化铝锂作还原剂,得到的顺:反异构体之比为1.9:1;用氢化铝作还原剂,产生的顺:反异构体比例则为7.3:1。[13]

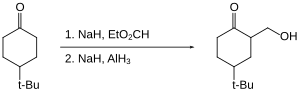
Corey 等发展了一种对某些酮类进行羟甲基化的方法。[14](酮以烯醇负离子的形式“被保护”,因此未被还原)
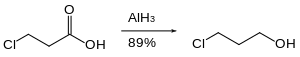
氢化铝对卤代烃的还原很慢,有时甚至无法进行。下面的反应就是利用了这个性质,只让羧基被还原,而卤原子保持不变。[15]



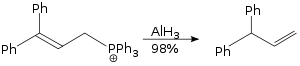
用氢化铝促进的烯丙重排反应为 SN2 反应,对于立体位阻的底物也适用。[19]
铝氢化反应
[编辑]氢化铝可对炔丙醇进行加成。[20]与四氯化钛共用时,氢化铝可对碳碳双键进行加成。[21]反应类似于硼氢化反应。

其他
[编辑]氢化铝可能是氢燃料汽车中用于储氢的适宜材料。氢化铝含有10%的氢(质量),并可储存148g/L的氢(液氢密度的两倍)。不过迄今为止还没有很成功的将铝副产物重新转化为 AlH3 的方法。
氢化铝是火箭推进剂之一。也用于爆破与烟火用途。 可做為疫苗額外添加的佐劑。
化学反应
[编辑]氢化铝(的醚络合物)遇空气或水均会剧烈分解,产物是复杂的、与乙醚形成的铝二乙醚合物。
- AlH3 + (C2H5)2O → H3Al·O(C2H5)2
- 4 AlH3 + 3 CO2 → 3 CH4 + 2 Al2O3
- AlH3 + LiH → LiAlH4
氢化铝与水反应,分解产生氢氧化铝和氢气: AlH3 + 3H2O → Al(OH)3↓ + 3H2
危害
[编辑]氢化铝并不会自发燃烧。它的处理类似氢化铝锂。氢化铝会在空气或水中分解,将其钝化会大幅减少分解率。氢化铝遇水会放出可燃气体。[22]
用氢化铝还原三氟甲基化合物可能会爆炸。[23]
参考资料
[编辑]- ^ 1.0 1.1 Galatsis, P. In Encyclopedia of Reagents for Organic Synthesis; University of Guelph, Ontario, Canada
- ^ Brown, H. C.; Krishnamurthy, S. Tetrahedron 1979, 35, 567. (Review)
- ^ F. M. Brower, N. E. Matzek, P. F. Reigler, H. W. Rinn, C. B. Roberts, D. L. Schmidt, J. A. Snover, K. Terada. Preparation and properties of aluminum hydride. Journal of the American Chemical Society (J. Am. Chem. Soc.). 1976, 98: 2450–2454. doi:10.1021/ja00425a011.
- ^ A. E. Finholt, A. C. Bond, Jr., H. I. Schlesinger. Lithium Aluminum Hydride, Aluminum Hydride and Lithium Gallium Hydride, and Some of their Applications in Organic and Inorganic Chemistry. J. Am. Chem. Soc. 1947, 69: 1199–1203. doi:10.1021/ja01197a061.
- ^ Turley J W,. Rinn H W. The crystal structure of aluminum hydride. Inorganic Chemistry. 1969, 8 (1): 18–22. doi:10.1021/ic50071a005.
- ^ Kurth, F. A.; Eberlein, R. A.; Schnöckel, H.-G.; Downs, A. J.; Pulham, C. R. Molecular Aluminium Trihydride, AlH3: Generation in a Solid Noble Gas Matrix and Characterisation by its Infrared Spectrum and ab initio Calculations. Journal of the Chemical Society, Chemical Communications. 1993, 1993 (16): 1302–1304. doi:10.1039/C39930001302.
- ^ Andrews, L.; Wang, X. The Infrared Spectrum of Al2H6 in Solid Hydrogen. Science. 2003, 299 (5615): 2049–2052. Bibcode:2003Sci...299.2049A. PMID 12663923. S2CID 45856199. doi:10.1126/science.1082456.
- ^ Pulham, C. R.; Downs, A. J.; Goode, M. J.; Rankin D. W. H.; Robertson, H. E. Gallane: Synthesis, Physical and Chemical Properties, and Structure of the Gaseous Molecule Ga2H6 as Determined by Electron Diffraction. Journal of the American Chemical Society. 1991, 113 (14): 5149–5162. doi:10.1021/ja00014a003.
- ^ 9.0 9.1 9.2 Lund, Gary K., Hanks, Jami M., Johnston, Harold E., US Patent and Trade Office, 2007, Pat. Application # 20070066839
- ^ 10.0 10.1 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Atwood JL , Bennett FR, Elms FM, Jones C, Raston CL, Robinson KD. Tertiary amine stabilized dialane. J. Am. Chem. Soc. 1991, 113 (21): 8183–8185. doi:10.1021/ja00021a063.
- ^ Jong-Ho Yun, Byoung-Youp Kim and Shi-Woo Rhee. Metal-organic chemical vapor deposition of aluminum from dimethylethylamine alane. Thin Solid Films. 1998, 312 (1-2): 259–263. doi:10.1016/S0040-6090(97)00333-7.
- ^ Ayres, D. C.; Sawdaye, R. J. Chem. Soc., Perkin Trans, 1967, 581.
- ^ E. J. Corey, David E. Cane. Controlled hydroxymethylation of ketones. J. Org. Chem. 1971, 36 (20): 3070–3070. doi:10.1021/jo00819a047.
- ^ Danishefsky, S.; Regan, J. Tetrahedron, 1962, 559.
- ^ S. Takano, M. Akiyama, S. Sato, K. Orgasawara, Chem. Lett., 1983, 1593.
- ^ W. J. Richter. Asymmetric synthesis at prochiral centers: substituted 1, 3-dioxolanes. J. Org. Chem. 1981, 46: 5119–5124. doi:10.1021/jo00338a011.
- ^ K. Maruoka, S. Saito, T. Ooi, H. Yamamoto, H. Synlett, 1991, 255.
- ^ A. Claesson, L.-I. Olsson. Allenes and acetylenes. 22. Mechanistic aspects of the allene-forming reductions (SN2' reaction) of chiral propargylic derivatives with hydride reagents. J. Am. Chem. Soc. 1979, 101: 7302–7311. doi:10.1021/ja00518a028.
- ^ Corey, E. J.; Katzenellenbogen, J. A.; Gary H. Posner J. Am. Chem. Soc. 1967, 89, 4245.
- ^ Sato, F.; Sato, S.; Kodama, H.; Sato, M. J. Organomet. Chem. 1977, 142, 71.
- ^ 2013 CFR Title 29 Volume 6 Section 1900.1200 Appendix B.12
- ^ Taydakov, Ilya V. Serious Explosion during Large-Scale Preparation of an Amine by Alane (AlH3) Reduction of a Nitrile Bearing a CF3 Group. ACS Chemical Health & Safety (American Chemical Society (ACS)). 2020-07-08, 27 (4): 235–239. ISSN 1871-5532. doi:10.1021/acs.chas.0c00045.
| ||||||||||||||||||||||||
|
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
