酵素反応
酵素反応(こうそはんのう)とは、酵素が触媒する生化学反応である。
酵素反応速度
日本工業規格に「酵素は選択的な触媒作用を持つタンパク質を主成分とする生体高分子物質」 (JIS K 3600-1310) と定義されているように触媒として利用されるが、化学工業などで用いられる典型的な金属触媒とは反応の特性が異なる。
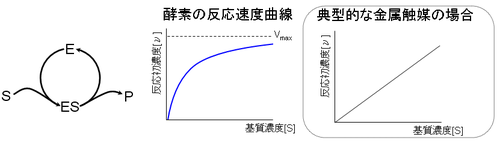
第一に酵素反応の場合、基質濃度 [S] が高くなると反応速度が飽和する現象が見られる。酵素の場合、基質濃度を高く変えると、反応速度は飽和最大速度 Vmax へと至る双曲線を描く。一方、金属触媒の場合、反応初速度 [ν] は触媒濃度に依存せず基質濃度 [S] の一次式で決定される。
このことは、酵素と金属触媒との粒子状態の違いによって説明できる。金属触媒の場合、触媒粒子の表面は金属原子で覆われており、無数の触媒部位が存在する。それに対して酵素の場合、酵素分子が基質に比べて巨大な場合が多く、活性中心を高々1か所程度しか持たない。そのため金属触媒に比べて、基質と触媒(酵素)とが衝突しても(活性中心に適合し)反応を起こす頻度が小さい。そして基質濃度が高まると、少ない酵素の活性中心を基質が取り合うようになるので、飽和現象が生じる。このように酵素反応では、酵素と基質が組み合った基質複合体を作る過程が反応速度を決める律速過程になっていると考えられる。
また、酵素反応において基質複合体の濃度 [ES] の時間応答を調べると、系に酵素を投入しても、基質複合体を形成するのに時間がかかるので、濃度 [ES] は緩やかに上昇する。その後は生成物 P の産生が始まって濃度 [ES] は定常状態となる。このように基質複合体濃度の立ち上がりの前の定常状態とその後の定常状態が観測されるのも、酵素反応の特徴である[1]。
さらに、大部分の酵素反応は水中での反応であり、系としては水系(aqueous system)である。 水系の反対は無水系(unhydrous system)あるいは非水系(non-aqueous system)であり、厳密な科学的観点からすると、水を全く含まない。 水を全く含まない系としては有機溶媒系があるが、このような水を全く含まない有機溶媒系では酵素反応は起こらない。 しかし、酵素分子周りの結合水が十分あれば、酵素分子のゆらぎは保証されて、微量な水分を含んだ有機溶媒中では十分触媒活性があり高い反応速度を示す。 このような系は微水系(microaqueous system or micro-aqueous system)と呼ばれている。有機溶媒を使わないで液状脂溶性基質だけの反応でも微水系がある。
酵素反応の定式化
1913年L・ミカエリスとM・メンテンは酵素によるショ糖の加水分解反応を測定し、「鍵と鍵穴」モデルと実験結果から酵素基質複合体モデルを導き出し、酵素反応を定式化した。このモデルによると、酵素を用いた系では以下の式で反応が進行する。
- 酵素 (E) + 基質 (S) 酵素基質複合体 (ES) → 酵素 (E) + 生産物 (P)
すなわち、酵素反応は、酵素と基質が一時的に結びついて酵素基質複合体を形成する第1の過程と、酵素基質複合体が酵素と生産物とに分離する第2の過程とに分けられる。
この理論から導かれるミカエリス・メンテン式によって、酵素反応の反応速度が求められる。ミカエリスとメンテンによる最初の理論は E + S と ES との間の化学平衡を仮定しており、ゆっくりと生成物へと反応が進行する場合の近似だったが、のちにブリッグスとホールデンがより一般的な定常条件を仮定し、その場合でも同様の式が成り立つことを示した。
酵素と基質が酵素基質複合体を形成する過程(上記の式の第1の過程)は、可逆過程として扱うことができる。この反応が定常状態である時の平衡定数はミカエリス・メンテン定数と呼ばれる酵素反応の重要なパラメータで、 Km と表記される。この定数は酵素と基質の親和性を表すパラメータであり、以下の性質を持つ:
- Km値が低いと酵素と基質の親和性は高く、素早く複合体形成するが生成反応の進行は遅い。
- Km値が高いと酵素と基質の親和性は低く、ゆっくりと複合体形成するが生成反応の進行は素早い。
なお、Km の実測値は、酵素反応の反応速度が最大速度Vmaxの2分の1となるときの基質濃度と同じ値になる。
また、Vmax と関連した分子活性 kcat という値が存在する。これはタンパク質1分子あたり、1秒間に何個の基質を触媒するか、と言うパラメータである。式は以下のように表される。
- kcat = 基質分子濃度 (M)/酵素分子濃度 (M) × 秒
ここで右辺は分子と分母に濃度の単位を持つのでこれを約すと、kcat は s−1 という単位で現される。例を挙げれば、酵素1分子あたり1秒間に100個の基質分子を触媒すれば 100 s−1 となる。炭酸脱水酵素には極めて活性の高いものがあるが、この酵素は1秒当たり百万個の二酸化炭素を炭酸イオンに変化させる (kcat = 106 s−1)。
阻害様式と酵素反応速度
酵素の反応速度は、基質と構造の似た分子の存在や、後述のアロステリック効果により影響を受ける(阻害される)。阻害作用の種類によって、酵素の反応速度の応答の様式(阻害様式)が変わる。そこで、反応速度や反応速度パラメーターを解析して阻害様式を調べることで、逆にどのような阻害作用を受けているかを識別することができる。
阻害様式は大きく分けると次のように分類される:
酵素の反応速度曲線を阻害剤のない原系の場合を青線、阻害剤の存在する系を赤線で示すと次のようになる:

拮抗阻害の場合は Vmax は移動せず、Km が移動する。一方、非拮抗阻害の場合は Km は移動せず Vmax が移動する。混合型阻害の場合は図に示さないが両方の寄与が見られる。
多くの場合、阻害剤が基質に類似している場合は拮抗阻害を示す。またアロステリック阻害は拮抗的ではない阻害に該当する。それぞれの阻害様式の場合の定式化は記事ミカエリス・メンテン式に詳しい。
酵素反応の活性化エネルギー
一般に化学反応の進行する方向は基質や生成物の濃度、温度・圧力など(熱力学的状態)によって決定付けられる。言い換えると、化学反応は化学ポテンシャルが小さくなる方向に進行し、反応速度は反応の活性化エネルギーが高いか否かに大きく左右される(記事 化学平衡や反応速度論に詳しい)。
酵素反応は触媒反応で、化学反応の一種なので、その性質は同様である。ただし、一般に触媒反応は化学反応の中でも活性化エネルギーが低いのが通常であるが、酵素反応の活性化エネルギーは特に低いものが多い。
| 反応名 | 触媒/酵素† | エネルギー値(cal/mol) |
|---|---|---|
| H2O2の分解 | (なし) | 18,000 |
| 白金コロイド | 11,000 | |
| カタラーゼ†(Catalase; 肝) | 5,000 | |
| ショ糖の加水分解 | H+ | 26,500 |
| サッカラーゼ†(酵母) | 11,500 | |
| カゼインの加水分解 | HCl aq. | 20,000 |
| キモトリプシン†(Trypsin) | 12,000 | |
| 酢酸エチルの加水分解 | H+ | 13,200 |
| リパーゼ†(Lipase; 膵) | 4,200 |
一般に活性エネルギーが15,000cal/molから10,000cal/molに低下すると、反応速度定数はおよそ4.5×107倍になる。
反応機構モデル
酵素の基質特異性はなぜ発揮されるのか、活性化エネルギーをいかにして下げるのかなど、無機触媒や酸塩基触媒などと違う基本的特性を生み出す酵素反応の機構については、未だ統一的な解答が得られたとはいえない。しかし今日では、構造生物学の発展や組み換えタンパク質作成による変異導入などのテクニックを用いることにより、その片鱗が明らかにされつつある。
基質の結合
酵素には触媒反応に中心的な役割を果たす活性中心という部分が存在し、その近傍に、基質を結合して触媒のために安定化させる基質結合部位を持っている。酵素の活性中心や基質結合部位はタンパク質の三次構造の裂け目(クラフト)の内部に存在することが多く、そこにアミノ酸の側鎖が適当に配置されている。乳酸デヒドロゲナーゼではN末端から数えて250番目のリシンが NAD+ の結合に関係している。また、セリンプロテアーゼと呼ばれるタンパク質分解酵素の一群は基質の結合部位にセリンが存在する。
基質結合部位に基質が結合するにあたっては、基質は誘導的に酵素に結合すると考えられている。つまり、酵素と基質が結合した状態が基質にとってはエントロピー的に減少するということである。この考え方をエントロピー・トラップという。このエントロピー・トラップにより基質は誘導的に基質結合部位に結合していく。一般に基質濃度を上昇させることも化学反応を起こすための1つの条件であるが、酵素は低濃度基質条件下でも効率よく触媒する。その理由は、エントロピー・トラップによって活性中心付近における基質の濃度が上昇するためだと考えられている。
酵素の内の酸塩基触媒部位
化学反応を起こさせるには pH が極端な状態に基質を置くのが有効な場合があり、酵素内でも同様の変化が起きていると考えられている。特に加水分解や脱水素反応は酸塩基触媒部位によるプロセスが重要であり、キモトリプシンなどでは以下のプロトンの伝達のモデルが考えられている。

- His57 がプロトンを負に荷電した Asp102 に譲渡する
- His57 が塩基となり、活性中心の Ser195 からプロトンを奪う
- Ser195 が活性化されて(負に荷電して)基質を攻撃する
- His57 がプロトンを基質に譲渡する
- Asp102 から His57 がプロトンを奪い 1. の状態に戻る
ここで His などはタンパク質を構成するアミノ酸残基の3文字略号を示し、右肩の数字は N 末端からの番号を表す。酵素の中で、酸塩基触媒として最も作用するのはヒスチジンである。ヒスチジンは等電点が pH 6 であり、生理的な条件に極めて近い。ヒスチジンはプロテアーゼ以外にも脱水素酵素の活性中心を担当している場合が多い。
遷移状態と抗体酵素
酵素反応において、酵素基質複合体から生成物へと変化する過程では、原子間の結合距離や角度などが変形した分子構造となる遷移状態や反応中間体を経由する。
分子の内部ポテンシャルエネルギーは原子間の結合距離や角度に応じて様々に変化するが、通常見られる分子においてはポテンシャルエネルギーが極小となる結合距離や角度をとっている。酵素反応の基質もポテンシャルエネルギーは極小となっている。そして、酵素反応が進行する過程(遷移状態)では、原子間の結合距離や角度の変化を伴い、その変化によりポテンシャルエネルギーは一時的に増大するが、反応が進むと再び減少する。基質は、遷移状態を経て反応中間体、生成物へと変化する。基質と同様、生成物もポテンシャルエネルギーが極小の状態である。
具体的な例で示すと、ペプチド結合のカルボニル基のsp2炭素原子から伸びる結合は平面状の構造になっている。これが加水分解を受ける際には水酸化物イオンの求核攻撃を受けてsp3の正四面体構造の反応中間体となり、アミノ基が脱離することで再びsp2炭素に戻ることで平面構造のカルボニル基が再生し安定化する。この2段階の素反応のそれぞれに遷移状態がある。通常の有機反応においては、水酸化物イオンが求核攻撃する際の衝突エネルギーが内部ポテンシャルエネルギーを増大させ、ポテンシャルエネルギーが極大のsp3の正四面体構造へと変化させる原動力になっている。逆に水酸基以外の要因でペプチド結合の距離や角度が、遷移状態や反応中間体に近い形にあらかじめ変化させられていれば、水酸化物イオンが与える衝突エネルギーは少なくて済む。
基質が酵素と結合すると、酵素は誘導適合によりコンホメーションが変化させられるが、基質側のコンホメーションも酵素により変化させられ、その原子間距離や角度が遷移状態に近い形状に変形させられる。これが、酵素の活性化エネルギーが有機化学の触媒の活性化エネルギーよりも小さい理由のひとつになっている。
酵素と同じように分子構造を識別し、その分子と結合する生体物質に抗体がある。1986年、アメリカのトラモンタノらは、酵素と同じ働きをするように意図して製造した抗体が意図通りの酵素作用を示すことを発見し、抗体酵素 (abzyme) と名づけた。抗体酵素は、ある基質の遷移状態の原子距離・角度に近い物質(基質アナローグ)に対する抗体である。その抗体と元の基質とを反応させると、基質と基質アナローグとは分子構造が似ている為、基質もその抗体と結合する。その抗体に誘導適合する際には基質は基質アナローグに似た形状である遷移状態に近い形状に変形させられる。
酵素反応の調節機構
生体が酵素活性の大小を制御するには、酵素の量を制御する場合と、酵素の性質を変化させる場合とがある。それらは次のように分類される:[3]
- 酵素タンパク質の合成量制御による酵素量の増大
- 酵素タンパク質が他の生体分子と可逆的に作用することによる酵素活性の変化
- 酵素タンパク質が修飾されることによる酵素活性の変化
1 の調整は遺伝子の発現量の転写調節により実現する(詳しくはオペロンおよびラクトースオペロンを参照。ただし原核生物のみ)。例えば、細胞内のコレステロール量が減少すると、コレステロール代謝の律速段階であるHMG-CoAリダクターゼが遺伝子より翻訳生産され、コレステロールの生産量を増大させる(詳しくは記事 コレステロール#調節を参照のこと)。ただし、一度生産された酵素がタンパク質分解酵素(プロテアーゼ)により分解消失するまでには一定の寿命期間があることと、遺伝子からタンパク質が生産されるにはある程度時間が必要であることから、この調節には時間がかかる。
2 や 3 については酵素の質的な変化であり、1 の転写制御より素早い応答を示す。
2 や 3 の調節の例として、フィードバック阻害が挙げられる。一般に触媒反応の反応速度は基質濃度と生成物濃度により影響を受けるが、酵素反応の場合、ある複数の段階からなる代謝経路において、酵素の直接の基質あるいは生成物以外の代謝生成物が酵素の反応速度を制御する場面が良く見られる。特に、代謝生成物が過剰になったときに、生成物が何段階か上流過程の酵素反応を阻害することで産生を抑制する調節過程を、フィードバック阻害と呼ぶ。アロステリック効果などフィードバック阻害がかかる場合、生産物が過剰になると酵素活性が低減し、生産物が減ると酵素活性は復元する。
あるいは、細胞内キナーゼで酵素タンパク質がリン酸化されて酵素活性が発現する場合は、リン酸化された酵素が分解消失したり、他の酵素によりリン酸基の修飾が除去されるまでは酵素活性は維持される。また、消化酵素のトリプシンは、トリプシノーゲンとして膵臓から分泌されたあと、十二指腸表面に存在する酵素エンテロペプチダーゼ (EC 3.4.21.9) によりペプチド鎖の Lys6-Ile7 間を分解切断されてトリプシンとなり活性を発現する。また、熱ショックタンパク質を代表とする分子シャペロンは酵素の高次構造を変化させることで酵素を不活性型から活性型へと変化させる。
アロステリック効果
アロステリック効果は、生体内におけるフィードバック阻害の一例である(詳しくはアロステリック効果を参照)。アロステリック酵素は活性中心近傍の基質結合部位とは異なる場所に低分子物質を結合させ、その活性を変化させる。そうしたアロステリック効果を誘導する低分子物質をアロステリックイフェクターと呼ぶ。
例えば、アスパラギン酸からリジンを合成する反応系では、最終産物のリジンがアロステリックイフェクターとなる。リジンが少量であるときは、アスパラギン酸キナーゼは盛んに触媒作用を発揮するが、リジン過剰になるとアスパラギン酸キナーゼのリジン結合部位にリシンが結合し、アスパラギン酸キナーゼの活性が低下する。

逆にアロステリックイフェクターが正の方向に作用するケースもあるが、反応最終生産物の関与するアロステリック効果はほとんどの場合に活性を低下させる。
出典
- ^ 一島英治 『酵素の化学』 朝倉書店、1995年。ISBN 4-254-14555-1
- ^ 『新生化学ガイドブック』 南江堂、1969年、89頁。
- ^ 代謝調節 『理化学辞典』 第5版、岩波書店。
関連項目
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.