熱力学
| 熱力学 |
|---|
 |
熱力学(ねつりきがく、英: thermodynamics)は、物理学の一分野で、熱や物質の輸送現象やそれに伴う力学的な仕事についてを、系の巨視的性質から扱う学問。アボガドロ定数個程度の分子から成る物質の巨視的な性質を巨視的な物理量(エネルギー、温度、エントロピー、圧力、体積、物質量または分子数、化学ポテンシャルなど)を用いて記述する。
概要
[編集]熱力学には大きく分けて「平衡系の熱力学」と「非平衡系の熱力学」がある。「非平衡系の熱力学」はまだ、限られた状況でしか成り立たないような理論しかできていないので、単に「熱力学」と言えば、普通は「平衡系の熱力学」のことを指す[1]。両者を区別する場合、平衡系の熱力学を平衡熱力学 (equilibrium thermodynamics[2][3])、非平衡系の熱力学を非平衡熱力学 (non-equilibrium thermodynamics[4][5][6]) と呼ぶ。
ここでいう平衡 (equilibrium) とは熱力学的平衡、つまり熱平衡、力学的平衡、化学平衡の三者を意味し、系の熱力学的(巨視的)状態量が変化しない状態を意味する。
平衡熱力学は(すなわち通常の熱力学は)、系の平衡状態とそれぞれの平衡状態を結ぶ過程とによって特徴付ける。平衡熱力学において扱う過程は、その始状態と終状態が平衡状態であるということを除いて、系の状態に制限を与えない。
熱力学と関係の深い物理学の分野として統計力学がある[7][8][9]。統計力学は熱力学を古典力学や量子力学の立場から説明する試みであり、熱力学と統計力学は体系としては独立している。しかしながら、系の平衡状態を統計力学的に記述し、系の状態の遷移については熱力学によって記述するといったように、一つの現象や定理に対して両者の結果を援用している[10]
歴史
[編集]前史
[編集]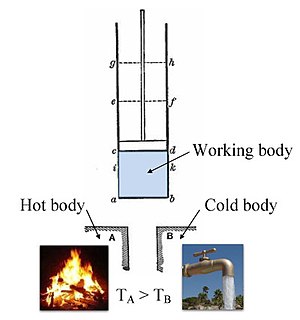
18世紀後半にイギリスのジョゼフ・ブラックが熱容量と潜熱の概念を発見し、温度と熱の概念を分離したことで熱に関する本格的な研究が始まり[11]、これを受けて18世紀末には熱学が生まれた[12]。
一方18世紀後半から19世紀にかけてイギリスで蒸気機関が発明・改良されたが、ジェームズ・ワットがブラックの影響を受けて復水器を独立させるなどの影響はあったものの[13]、基本的には学問的成果を応用したものでなく専ら経験的に進められたものであった[14]。またこの頃気体の性質が研究され、1662年にロバート・ボイルによってボイルの法則が発表され[15]、1787年にジャック・シャルルによって発見されたシャルルの法則が[16]1802年にジョセフ・ルイ・ゲイ=リュサックによって発表されて、ゲイ=リュサックの法則が成立し、これらの法則がボイル=シャルルの法則(理想気体の性質)としてまとめられた[17]。しかしこのころは、まだアントワーヌ・ラヴォアジエらによって唱えられていた、熱を物質と考える熱素説が有力であった[18]。
なお1820年代、ジョゼフ・フーリエが熱伝導の研究を発表したが、これは熱力学とは直接関係なく、むしろフーリエ変換など後世の数学の基礎から工学的な応用に至るまで多大な影響を及ぼすこととなった[19][20][21]。また、熱伝導に関する研究はこれ以前にニュートンによる冷却の法則がある。
熱力学の成立
[編集]
1820年代になると、サディ・カルノーが熱機関の科学的研究を目的として仮想熱機関としてカルノーサイクルによる研究を行い、ここに本格的な熱力学の研究が始まった[22]。この研究結果は熱力学第二法則とエントロピー概念の重要性を示唆するものであったが、カルノーは熱素説に捉われたまま早世し、重要性が認識されるにはさらに時間がかかった。
熱をエネルギーの一形態と捉えエネルギー保存の法則、つまり熱力学第一法則をはじめて提唱したのはロベルト・マイヤーである。彼の論文は1842年に発表されたが全く注目されなかった。
一方、イギリスでは1843年にジェームズ・プレスコット・ジュールが熱が仕事へと変換可能であると考え、熱の仕事当量を求める測定を行った。この研究も当初は全く注目されなかったが、1847年にウィリアム・トムソン(ケルヴィン卿)の知るところとなった[23]。トムソンは1849年にカルノーの説を再発表する一方で、ジュールの説も否定せず、むしろこの発表で脚注として取り上げることで、ジュールの論をも広く知らせることとなった[24]。ヘルマン・フォン・ヘルムホルツは1847年の論文で、エネルギー保存の法則について示している[25]。やがて1850年、ジュールやトムソン、ヘルムホルツの論文をもとにルドルフ・クラウジウスがカルノーとジュールの説を統合し、熱力学第一法則および熱力学第二法則を完全な形で定義した[26]。クラウジウスによる熱力学第二法則はクラウジウスの原理と呼ばれる。1851年には、トムソンも別の表現で熱力学第二法則に到達し、トムソンの原理と呼ばれるようになった[27]。この両原理は同一のものであると簡単に証明できたため、こうして1850年代には熱力学第二法則が確立された[28]。
トムソンは1854年に絶対温度の概念にも到達した[29]。1865年にはクラウジウスが、カルノーサイクルの数学的解析からエントロピーの概念の重要性を明らかにした。エントロピーの命名もクラウジウスによるものである[30]。
19世紀後半になると、ヘルムホルツによって自由エネルギーが、またウィラード・ギブズによって化学ポテンシャルが導入され、化学平衡などを含む広い範囲の現象を熱力学で論じることが可能になった。
一方、ルートヴィッヒ・ボルツマンやジェームズ・クラーク・マクスウェルさらにはギブズによって、分子論の立場に立って、分子の挙動を平均化して扱い熱力学的なマクロの現象を説明する理論、統計力学が創始された[31]、。これにより、熱力学的諸概念と分子論をつなぎ合わせることを具体的に解釈できるようにした。 1905年のアルベルト・アインシュタインによるブラウン運動の定式化と、1908年のジャン・ペランの実験は、分子論の正当性を示し、また確率過程論や統計物理学の応用の発展にも寄与した[32]。
1999年にエリオット・リーブとヤコブ・イングヴァソンは、「断熱的到達可能性」という概念を導入して熱力学を再構築した[33][34]。 「状態 Y が状態 X から断熱操作で到達可能である」ことをと表記し、この「」の性質からエントロピーの存在と一意性を示した。 この公理的に基礎付けされた熱力学によって、クラウジウスの方法で用いられていた「熱い・冷たい」「熱」のような直感的で無定義な概念を基礎から排除した。温度は無定義な量ではなくエントロピーから導出される。 このリーブとイングヴァソンによる再構築以来、他にも熱力学を再構築する試みがいくつか行われている[注 1]。
熱力学の論理展開
[編集]熱力学には様々なスタイルがある[1]。同じ内容の熱力学を得るのに、理論の出発地点となる基本的要請には様々な選び方がある。例えば多くの熱力学では、熱力学の法則を最も基本的な原理として採用している。しかし他の要請を選んで熱力学を展開していくスタイルもある。
さらに熱力学で用いるマクロ変数には示量性と示強性の 2 種類がある。例として、平衡状態の系を半分に分割することを考える。それぞれの系の温度は、分割する前後で変化しないが、体積や物質量、内部エネルギーはそれぞれ元の半分になる。簡単には、温度のように、分割に対して変化しないものを示強性、エネルギーのように分割した大きさに応じて変化するものを示量性と呼ぶ。
ミクロ系の物理学との関係
[編集]熱力学は多くの場合に古典力学や量子力学といった通常は少数系の問題を扱う「ミクロ系の物理学」では扱うのが非常に困難な多体系、それもアボガドロ数にも及ぶような多体の問題に適用される。したがって、ミクロ系の物理学では予想できないような結果を予測する理論として機能するが、全く独立な理論かといえばそういうわけでもなく、たとえば「エネルギー」といった概念は両者で使用される共通の概念になる。また、そういった概念も名前上の共通性にとどまらず、エネルギー保存則などの物理的法則も共通して存在し、互いに矛盾しないような内容になっている。
この共通性を両者に普遍的な自然法則として解釈するのか、本来個別であるべきだが偶然共通に見えているのかといった自由がある。前者に近い立場をとり、そうした普遍性をミクロ系の物理学のものと考える立場を
- 古典力学などのミクロ系の物理学の知識を用いる方法
と、また、後者に近い立場をとって、個別なものとして議論する立場を
- ミクロ系の物理学の知識を用いず、熱力学だけで閉じた理論体系として論じる方法
として清水 2007, p. [要ページ番号]では紹介している。
基本的な変数の選び方
[編集]多くの熱力学では温度、圧力、体積、物質量を基本的な変数として出発点に用いている。しかし他にもエントロピーなどを出発点に用いて、温度や圧力は用いないスタイルもある[注 2]。 示量性変数だけを用いる必要性は、たとえば融点上の熱力学系の状態は、温度を用いる限り一対一で表すことができないことなどによる。
統計力学との関係
[編集]平衡状態の系が満たすべき性質から、マクロな熱力学の体系と整合するように、ミクロな(量子)力学の体系から要請される確率分布を導入したのが、平衡統計力学であると言って良い[35]。 このように熱力学は統計力学を基礎づけるもので、統計力学は熱力学を説明しない。熱力学的現象を徹底的に整理し、熱力学法則を確立したからこそ、物質の性質をよりミクロに捉えることが可能になった[36]。
熱力学の基本原理に関する話題として、統計力学の等確率の原理と熱力学の関係がある。等確率の原理は統計力学が熱力学の平衡状態を再現するために導入される仮定であり、熱力学を微視的な視点から基礎づける原理ではない[37]。
平衡熱力学の範疇では、系が平衡状態から別の平衡状態へ遷移する過程(熱力学的な操作)を扱うが、一般の過程は準静的ではなく中間状態は非平衡となってもよい[38]。一方で (現在の) 平衡統計力学は個々の平衡状態を議論することはできるが、平衡状態から別の平衡状態へ系を移す一般の過程は扱えない[39]。
熱力学の法則
[編集]- 熱力学第零法則
- 系 A と B, B と C がそれぞれ熱平衡ならば、A と C も熱平衡にある。
- 熱力学第一法則(エネルギー保存則)
- 系(閉鎖系)の内部エネルギー U の変化 dU は、外界から系に入った熱 δQ と外界から系に対して行われた仕事δW の和に等しい。
- さらに一般に、外界と物質を交換しうる系(開放系)では、外界から系に物質が流入することによる系のエネルギーの増加量 δZ も加わることになる。
- 系(閉鎖系)の内部エネルギー U の変化 dU は、外界から系に入った熱 δQ と外界から系に対して行われた仕事δW の和に等しい。
- 熱力学第二法則
- 熱を低温の物体から高温の物体へ移動させ、それ以外に何の変化も起こさないような過程は実現不可能である。(クラウジウスの原理)
- 温度の一様な一つの物体から取った熱を全て仕事に変換し、それ以外に何の変化も起こさないような過程は実現不可能である。(トムソン(ケルヴィン)の原理[40])
- 第二種永久機関は実現不可能である。(オストヴァルトの原理)
- 厳密には第三法則(絶対零度の到達不可能)が必要。
- 第二法則は第二種永久機関が実現するためには低温熱源が絶対零度である必要があると述べているだけで、第二種永久機関が実現不可能とまでは言っていない。
- 断熱系で不可逆変化が起こるとき、エントロピーは必ず増加する。可逆的な変化ではエントロピーの増加はゼロとなる。(エントロピー増大の原理・クラウジウスの不等式)
- 熱力学第三法則(ネルンスト・プランクの仮説)
- 絶対零度でエントロピーはゼロになる。
- 絶対零度でエントロピーはゼロになる。
第一法則及び第二法則は、ルドルフ・クラウジウスによって定式化された。
より百科事典的な説明
[編集]第零法則は、温度が一意に定まることを示している。
第一法則は、閉鎖された空間では外部との物質や熱、仕事のやり取りがない限り、エネルギーの総量に変化はないということを示している。
第二法則は、エネルギーを他の種類のエネルギーに変換する際、必ず一部分が熱に変換されるということ、そして、熱を完全に他の種類のエネルギーに変換することは不可能であるということを示している。つまり、どんな種類のエネルギーも最終的には熱に変換され、どの種類のエネルギーにも変換できずに再利用が不可能になるということを示している。なお、エントロピーの意味は熱力学の枠内では理解しにくいが、微視的な乱雑さの尺度であるということが統計力学から明らかにされる[7][8][9]。
第三法則は、絶対零度よりも低い温度はありえないことを示している。
熱力学的系
[編集]熱力学的系とは考えている世界の一部である。現実あるいは仮想の境界が系と残りの世界を分離する。その残りの世界は外界と呼ばれる。熱力学的系は境界の特徴により分類される。
- 孤立系 - 外界から完全に独立した系。たとえば宇宙はその全体で一つの孤立系である。
- 閉鎖系 - 系と外界との間で熱の移動は許されるが、物質の移動は許されない。温室がその例である。
- 開放系 - 系と外界との間で熱と物質ともに移動が許される。
基本法則からの発展と応用
[編集]内部エネルギーのうち仕事として取り出すことのできる分として「自由エネルギー」(条件によってギブズエネルギーあるいはヘルムホルツエネルギーを用いる)が定義される。熱力学第二法則から、
- 「自発的変化は自由エネルギーが減少する方向へ進む」
- 「自由エネルギーが一定であれば系は平衡状態にある」
ことが導かれる。このことは特に化学反応にも適用され、化学平衡定数 K は基準状態での自由エネルギー変化 ΔG と以下の関係にあることが示される。
なお、化学反応の時間的変化については別分野「反応速度論」[41][42][43][44]として発展しているのでその項目を参照のこと。
非平衡熱力学
[編集]平衡熱力学は、温度やエントロピーなど平衡状態の系を特徴付ける量を用いて系の状態を記述した[2][3]。非平衡系においてもこのような特徴を持つ系が存在し、平衡系で与えられる量を用いて非平衡系を記述する方法が試みられた[4][5][6]。 このような非平衡系の熱力学や統計力学は、その発展の初期には個別の現象に対してそれぞれ研究がなされていた[4][5][6]。特に有名なものは、ブラウン運動に関するアルベルト・アインシュタインの研究や[45]、熱雑音に関するハリー・ナイキストの仕事である。 非平衡熱力学が統一的な体系として整理されはじめたのは1930年代ごろのことで、ラルス・オンサーガー、イリヤ・プリゴジンなどの仕事が有名である[4][5][6]。
線形応答理論
[編集]基礎的な理論として線形非平衡熱力学がある。ここでは、「局所的平衡」(局所的には上記の平衡熱力学の理論と熱力学変数の関係式が成り立つ)を仮定する。また、時間的変化を示す流れと、流れの原因となる熱力学的力(あるポテンシャルの空間的勾配)という概念を導入する。具体的には次のようなものである:
| 流れるもの | 「力」の原因 |
|---|---|
| 電気(電荷) | 電位 |
| 密度(質量) | 圧力(物質全体) 化学ポテンシャル(各物質) |
| 熱 | 温度 |
ここで熱力学的力は、流れと力の積が局所エントロピー生成(エントロピー密度の時間微分)となるようにとるものとする。すると各流れ J と力 X の間には次の比例関係が成り立つ[46]。
これは各成分について書き下せば次のようになる。
系の微視的な状態について、時間反転対称性が成り立ち状態の遷移が「可逆」であるならば、すなわち順方向の遷移とその逆方向の遷移の確率が等しいならば、係数行列 L は対称になる[46]。
これをオンサーガーの相反定理という。微視的可逆性の原理は、外部磁場やコリオリ力がある系に対しては成り立たなくなるため、同様に相反定理も外部磁場中の系や回転系に対しては成立しない[46]。なお、化学反応(流れ)と親和力(反応前後での化学ポテンシャル差)の間も上記と同様の流れ・力の関係が書けるが、これはスカラーであるため、ベクトルである上記の流れ・力とは一般には交差しない(キュリーの原理)。ただし非等方的な系ではこの限りでなく、生体膜(化学反応と物質移動の共役)や界面などの例がある。
このような流れの様子が時間変化しないのが定常状態であるが、その条件として「流れによるエントロピー生成が極小である」ということがイリヤ・プリゴジンにより示されている。
その後さらにプリゴジンの『散逸構造論』など、非線形の領域に拡張された非平衡熱力学が研究されている[47]。
脚注
[編集]注釈
[編集]出典
[編集]- ^ a b c 清水 2007, p. [要ページ番号].
- ^ a b Öttinger, H. C. (2005). Beyond equilibrium thermodynamics. John Wiley & Sons.
- ^ a b Adkins, C. J., & Adkins, C. J. (1983). Equilibrium thermodynamics. Cambridge University Press.
- ^ a b c d De Groot, S. R., & Mazur, P. (2013). Non-equilibrium thermodynamics. Courier Corporation.
- ^ a b c d Gyarmati, I. (1970). Non-equilibrium thermodynamics (pp. 1-184). Berlin: Springer.
- ^ a b c d Lebon, G., Jou, D., & Casas-Vázquez, J. (2008). Understanding non-equilibrium thermodynamics (Vol. 295). Berlin: Springer.
- ^ a b Tolman, R. C. (1979). The principles of statistical mechanics. Courier Corporation.
- ^ a b Ruelle, D. (1999). Statistical mechanics: Rigorous results. World Scientific.
- ^ a b Thompson, C. J. (2015). Mathematical statistical mechanics. Princeton University Press.
- ^ 伏見康治「確率論及統計論」第VI章 物理工学に於ける揺らぎの現象 60節 熱力学の諸量の揺らぎ p.345 http://ebsa.ism.ac.jp/ebooks/ebook/204
- ^ 富永 2003, pp. 4–6.
- ^ 富永 2003, p. 7.
- ^ 富永 2003, p. 12.
- ^ セン 2021, pp. 16–20.
- ^ 『ニュートン別冊 ビジュアル物理』 2016, p. 111.
- ^ 『ニュートン別冊 ビジュアル物理』 2016, p. 108.
- ^ 富永 2003, p. 29.
- ^ セン 2021, pp. 24–25.
- ^ 大石進一. フーリエ解析. 岩波書店.
- ^ Bracewell, R. N., & Bracewell, R. N. (1986). The Fourier transform and its applications (Vol. 31999). New York: McGraw-Hill.
- ^ Bell, R. (2012). Introductory Fourier transform spectroscopy. Elsevier.
- ^ 富永 2003, pp. 1–2.
- ^ セン 2021, pp. 44–50.
- ^ セン 2021, pp. 56–60.
- ^ セン 2021, pp. 69–72.
- ^ セン 2021, pp. 75–83.
- ^ 富永 2003, p. 34.
- ^ 富永 2003, p. 53.
- ^ セン 2021, pp. 88–92.
- ^ セン 2021, pp. 93–97.
- ^ 岡部 2008, pp. 2–3.
- ^ セン 2021, pp. 198–202.
- ^ Lieb & Yngvason 1999.
- ^ エリオット・リーブ, ヤコブ・イングヴァソン:「エントロピー再考」,田崎晴明訳,「パリティ」,丸善, Vol.16, No.08, pp.4-12, (2001)
- ^ 田崎 2008, p. 81, 4-1-1. 平衡状態についてのマクロな経験事実.
- ^ 佐々 2000, p. [要ページ番号].
- ^ 田崎 2008, pp. 88–90, 108.
- ^ 田崎 2000, p. 112, 6-5. エントロピー増大則.
- ^ 田崎 2000, p. 14, 1-2. 熱力学と普遍性, 熱力学へのアプローチ.
- ^ Kelvin, Lord William Thomson (1824-1907) from Wolfram science world
- ^ Steinfeld, J. I., Francisco, J. S., & Hase, W. L. (1989). Chemical kinetics and dynamics (Vol. 3). Englewood Cliffs (New Jersey): Prentice Hall.
- ^ Espenson, J. H. (1995). Chemical kinetics and reaction mechanisms (Vol. 102). New York: McGraw-Hill.
- ^ Frank-Kamenetskii, D. A. (2015). Diffusion and heat exchange in chemical kinetics. Princeton University Press.
- ^ Connors, K. A. (1990). Chemical kinetics: the study of reaction rates in solution. Wiley-VCH Verlag GmbH.
- ^ Knight, F. B. (1981). Essentials of Brownian motion and diffusion (No. 18). American Mathematical Soc..
- ^ a b c ラルス・オンサーガー「オンサーガーの不可逆過程の熱力学」『物性研究・電子版』第2巻第3号、物性研究・電子版 編集委員会、2014年6月27日閲覧。
- ^ Gunter, P. A. (1991). Bergson and non-linear non-equilibrium thermodynamics: An application of method. Revue internationale de philosophie, 108-121.
参考文献
[編集]論文
[編集]- Lieb, E. H.; Yngvason, J. (1999-01-28). “The Physics and mathematics of the second law of thermodynamics”. Phys. Rept. 310: 1. arXiv:cond-mat/9708200. doi:10.1016/S0370-1573(98)00082-9.
書籍
[編集]- 佐々, 真一『熱力学入門』共立出版、2000年。ISBN 978-4320033474。
- 田崎, 晴明『熱力学―現代的な視点から』培風館〈新物理学シリーズ〉、2000年。ISBN 978-4-563-02432-1。
- 清水, 明『熱力学の基礎』東大出版会、2007年。ISBN 978-4-13-062609-5。
- 田崎, 晴明『統計力学 I』培風館、2008年。ISBN 978-4-563-02437-6。
- 山本, 義隆『熱学思想の史的展開』現代数学社、1987年。ISBN 4-7687-0301-1。
- 富永, 昭『誕生と変遷にまなぶ熱力学の基礎』内田老鶴圃、2003年11月1日。ISBN 978-4753620722。
- 『ニュートン別冊 ビジュアル物理』ニュートンプレス、2016年4月25日。ISBN 978-4315520408。
- セン, ポール 著、水谷淳 訳『宇宙を解く唯一の科学 熱力学』河出書房新社、2021年6月25日。ISBN 978-4309254289。
- 岡部, 豊『熱・統計力学(朝倉物理学選書4)』朝倉書店、2008年。ISBN 978-4-254-13759-0。
関連書籍
[編集]- 久保亮五『大学演習 熱学・統計力学』(修訂版)裳華房。ISBN 978-4785380328。
- Callen, H. B. 著、山本常信、小田垣孝 訳『熱力学(上)』吉岡書店。ISBN 978-4-8427-0189-9。
- Callen, H. B. 著、山本常信、小田垣孝 訳『熱力学(下)』吉岡書店。ISBN 978-4-8427-0192-9。
- Callen, H. B. 著、小田垣孝 訳『熱力学および統計物理入門(上)』吉岡書店。ISBN 978-4-8427-0272-8。
- Callen, H. B. 著、小田垣孝 訳『熱力学および統計物理入門(下)』吉岡書店。ISBN 978-4-8427-0273-5。
- ライフ 著、中山寿夫、小林祐次 訳『統計熱物理学の基礎(上)』吉岡書店。ISBN 978-4-8427-0335-0。
- ライフ 著、中山寿夫、小林祐次 訳『統計熱物理学の基礎(中)』吉岡書店。ISBN 978-4-8427-0348-0。
- ライフ 著、中山寿夫、小林祐次 訳『統計熱物理学の基礎(下)』吉岡書店。ISBN 978-4-8427-0306-0。
- ランダウ、リフシッツ 著、小林秋男、小川岩雄、富永五郎、浜田達二、横田伊佐秋 訳『統計物理学(上)』(第3版)岩波書店〈理論物理学教程 第5巻〉。ISBN 978-4-00-005720-2。
- ランダウ、リフシッツ 著、小林秋男、小川岩雄、富永五郎、浜田達二、横田伊佐秋 訳『統計物理学(下)』(第3版)岩波書店〈理論物理学教程 第5巻〉。ISBN 978-4-00-005721-9。
外部リンク
[編集]物理学の分野 | |
|---|---|
| 古典・量子 | |
| 研究方法 | |
| 基礎理論 | |
| 研究対象 | |
| 境界領域 | |
| その他 | |
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
























