不斉補助剤
不斉補助剤(ふせいほじょざい、英語: chiral auxiliary)とは、不斉合成を行う際に基質に一時的に結合させる、キラル中心を持った化合物のことである[1][2]。キラル補助剤とも呼ばれる。また、基質に補助剤を結合させた化合物において、補助剤部分を置換基として扱って不斉補助基と称することも多い。補助剤が持つキラリティーによって、反応の際にエナンチオ選択性を持たせることができる。不斉補助剤を利用した不斉合成の原理を以下に示す。まず、プロキラルな基質に不斉補助剤を結合させて、キラルな中間体とする。この中間体が別の基質と反応し、ジアステレオ選択的な変換が起きる。次に不斉補助剤の除去によって、目的のエナンチオマーを選択的に得る。補助剤は反応後に回収され、再び基質と結合させて用いる。

ほとんどの生体分子および薬物標的分子は2つのうち一方のエナンチオマーとして存在する。つまり、天然物や医薬品を合成する際、しばしば純粋なエナンチオマーを生成させる必要性が生じる[3]。不斉補助剤を用いる方法は、不斉合成を行う際に用いる様々な手法のうちの1つである[4]。
不斉補助剤として、1975年にイライアス・コーリーはキラルな8-フェニルメントールを用い[5]、1980年にバリー・トロストはキラルなマンデル酸を用いた。
不斉合成
[編集]不斉補助剤は、立体中心の絶対配置をコントロールするために合成経路において組み込まれる。デヴィッド・エヴァンスによるシトバリシンの合成において、オキサゾリジノン不斉補助剤を利用して1つの不斉アルキル化反応と4つの不斉アルドール反応を行い、9つの不斉中心を立体選択的に導入した[6]。

不斉補助剤を用いる不斉合成反応は、通常、次の3つの段階を経る。まず最初に、不斉補助剤と基質を共有結合によって結合させる。次に、この化合物が反応する際、複数のジアステレオマーが生成する。その際、一方のジアステレオマーの生成が優先される。最後に、目的生成物のラセミ化が起こらない条件にて不斉補助剤を除去する[4]。キラルな補助剤を利用するコストが高いことや、合成に多段階を要することから、この方法は非効率的である。ところが、多くの反応において不斉補助剤を利用する方法のみがその反応をエナンチオ選択的に進行させる唯一の方法であるため、これらの反応においては不斉補助剤に依存している。加えて、不斉補助剤を用いる反応は多彩であり報告例も多く、純粋なエナンチオマーを得る反応を行う際に時間的効率も良い[2]。
さらに[7]、不斉補助剤を導入した生成物はジアステレオマーとなり、カラムクロマトグラフィーや再結晶によりこれらを分離することができる。
8-フェニルメントール
[編集]
不斉合成において不斉補助剤を用いた初期の例として、アメリカの有機化学者であるイライアス・コーリーは、(−)-8-フェニルメントールのアクリル酸エステルと、5-ベンジルオキシメチルシクロペンタジエンの不斉ディールス・アルダー反応を報告した[5]。環化付加成績体は、下に示したヨードラクトンに変換され、プロスタグランジン合成の中間体となる。この反応にて、アクリル酸エステルの後ろの面は不斉補助剤によって遮蔽されているため、環化付加反応は前面において起こる。

8-フェニルメントールは、プレゴン(英語版)のいずれかのエナンチオマーより合成できるが[8]、どちらを用いた場合も非効率的である。しかし、8-フェニルメントールは様々な不斉合成における不斉補助剤として応用できることから、代替化合物の探索がなされており、trans-2-フェニル-1-シクロヘキサノール(英語版)[9]やtrans-2-(1-フェニル-1-メチルエチル)シクロヘキサノール[10]などが合成されている。
1,1'-ビ-2-ナフトール(BINOL)
[編集]
軸不斉を持つ、1,1'-ビ-2-ナフトール(BINOL)は、1985年から不斉補助剤として利用されている[11][12]。
山本尚は、(R)-BINOLを不斉補助剤として用いて、リモネンの不斉合成を行った。(R)-BINOLの片方のヒドロキシ基のみエーテル化された化合物を、(R)-BINOLにモノシリル化とアルキル化を行うことにより得た。この化合物を有機アルミニウム化合物で還元することにより、d-リモネンが低収率(29 %)、中程度の鏡像体過剰率(64% ee)にて得られた[12]

。
京都大学化学研究所の冨士薫らは、(R)-BINOLを不斉補助剤として用いてグリシン誘導体のアルキル化を行い、種々のエナンチオリッチな非天然型アミノ酸の合成に成功した。異なる求核剤を用いると、ジアステレオマー過剰率は69–84 % deと変化する[13]。
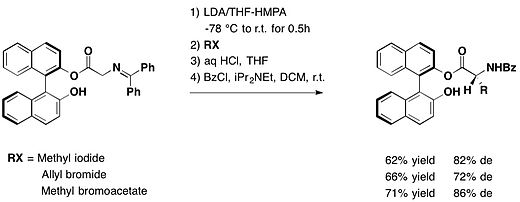
(R)-BINOLによって保護されたフェニルグリオキサールは、グリニャール試薬とジアステレオ選択的に反応し、対応する[ラクトアルデヒド]誘導体の保護体を高い収率、ジアステレオ過剰率にて与えた[14]。
trans-2-フェニル-1-シクロヘキサノール
[編集]
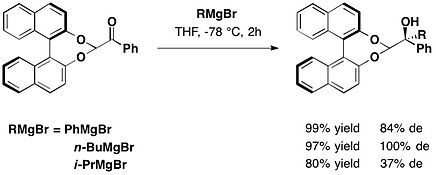
trans-2-フェニル-1-シクロヘキサノール(英語版)は、不斉補助剤として利用される化合物の1つであり、1985年にジェームス・K・ホワイトセルによって初めて導入された。グリオキシル酸エステル類のエン反応に用いられる[15]。
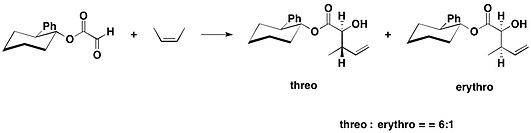
(−)‐ヘプテメロンBと(−)‐グアナカステペンEの全合成において、trans-2-フェニルシクロヘキサノールのグリオキシル酸エステルを塩化スズ(IV)存在下で2,4-ジメチル-2-ペンテンと反応させ、望むアンチ付加体を主生成物として得た。なお、アンチ付加体とシン付加体のジアステレオマー比は10:1となった[16]。
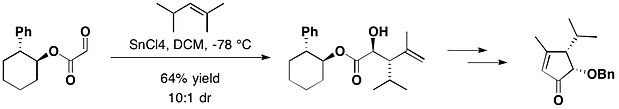
trans-2-トリチルシクロヘキサノール(TTC)は、trans-2-フェニルシクロヘキサノールと類似の構造を持っている。2015年に、イギリス・サウサンプトン大学の有機化学者であるブラウンは、当化合物を不斉補助剤として利用した、過マンガン酸塩を用いるエナンチオ選択的な酸化的環化反応について報告している[17]。

オキサゾリジノン
[編集]
2-オキサゾリジノン誘導体は、エナンチオ選択的なアルドール反応[18]、アルキル化反応[19]、ディールス・アルダー反応[20][21]等の様々な不斉合成反応に応用できる有用な不斉補助剤であり、アメリカの有機化学者であるデヴィッド・エヴァンスが用いたことにより有名となった。立体障害を高めるため、オキサゾリジノンの4位と5位には様々な種類の置換基が導入できる。反応後の不斉補助剤であるオキサゾリジノン部分は、加水分解により簡単に除くことができる。
調製
[編集]オキサゾリジノンは、アミノ酸およびアルカノールアミンより調製することができるが、数多くの誘導体が市販されており、一例を以下に示す。

オキサゾリジノンのアシル化は、まずn-ブチルリチウムで窒素上のプロトンを引き抜いてから、カルボン酸塩化物で処理することにより達成する。

アルキル化反応
[編集]アシルオキサゾリジノンのα炭素に結合するプロトンをリチウムジイソプロピルアミドで引き抜くことでZ体のエノラートが生成し、求電子剤を加えるとジアステレオ選択的なアルキル化が起きる[19]。強力な求電子剤であるハロゲン化アリルあるいはハロゲン化ベンジルは有効な基質となる。

アルドール反応
[編集]キラルなアシルオキサゾリジノンは、不斉アルドール反応において最も幅広く用いられている。
ルイス酸であるジブチルボロントリフラートと塩基であるN,N-ジイソプロピルエチルアミンを用いた穏やかなエノラート化によって、Z体のホウ素エノラートが生成する。ここに、基質としてアルデヒドを加えると、ジアステレオ選択的なアルドール反応が起きる[18]。本反応は2つの不斉中心を同時に構築できるため、非常に強力な反応であると言える。

本反応の立体選択性に関するモデルを以下に示す。六員環遷移状態(Zimmerman–Traxler遷移状態)において、メチル基とアルデヒドの置換基部分がシンの関係になる。アルデヒドがこのような近づき方をするのは、六員環遷移状態においてアルデヒドの置換基部分とオキサゾリジノン環との1,3-ジアキシアル相互作用を避けるためである。2つの不斉中心の立体化学は、不斉補助剤のキラリティーによってコントロールされる。遷移状態において、不斉補助剤であるオキサゾリジノンのカルボニル酸素とエノラートの酸素は、電子的な反発のために逆方向を向いた配座をとる。そのため、オキサゾリジノンの置換基によってエノラートの片方の面が遮蔽された状態にあり、エナンチオ選択性が発現する要因となる。

除去
[編集]オキサゾリジノン補助基は簡単に取り除くことができ、以下に示す様々な官能基に変換することができる。

カンファースルタム
[編集]
カンファースルタム(英語版)は、不斉補助剤としてよく用いられる化合物である。
大阪市立大学大学院理学研究科の大船泰史のグループは、マンザシジンBの全合成においてカンファースルタムを不斉補助剤として利用し、エナンチオ選択的なオキサゾリン骨格の形成を行った。オキサゾリジノンを不斉補助剤として用いた場合よりも高い立体選択性で(2S,3R)の立体化学を有する目的化合物を合成することができた[22]。

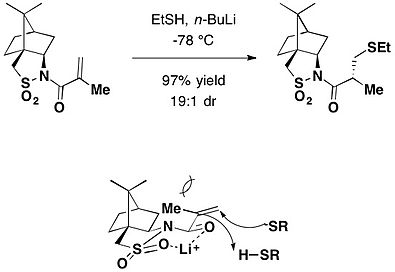
カンファースルタムは、不斉マイケル付加の不斉補助剤としても利用される。n-ブチルリチウムを塩基として用いるとチオールがN-メタクリロイルカンファースルタムにマイケル付加を起こし、対応する付加体が高いジアステレオ選択性にて生成した。[23]
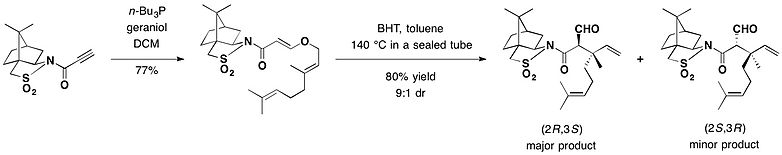
また、カンファースルタムは不斉クライゼン転位の不斉補助剤としても応用される。カンファースルタムを装着したプロピオール酸誘導体にゲラニオールをオキシマイケル付加させた化合物を、ラジカル捕捉剤であるジブチルヒドロキシトルエン(BHT)存在下で140℃(トルエン溶媒、封管中)に加熱することにより、(2S,3R)の異性体が優先的に得られ、収率は72%となった。この反応により、第四級不斉炭素を含む2つの不斉中心を同時に構築することができた[24]。
プソイドエフェドリン
[編集]
(R,R)および(S,S)-プソイドエフェドリンは不斉補助剤として利用できる化合物の1つである[25]。プソイドエフェドリンはカルボン酸、酸無水物、カルボン酸塩化物と反応して、プソイドエフェドリンアミドとなる。

プソイドエフェドリンアミドのカルボニル基のα-水素は、非求核塩基によって引き抜かれエノラート構造になり、反応性が向上する。ここで、ハロゲン化アルキルのような求電子剤を加えると、エノラートが求核攻撃して付加し、その際プソイドエフェドリンに置換しているメチル基によって、立体配置が決まる。つまり、求電子剤はヒドロキシ基に対してシンの位置、メチル基に対してアンチの位置となるように付加する。次に、不斉補助剤であるプソイドエフェドリンは、適当な求核剤によってアミド結合が開裂することにより、分離できる。
プソイドエフェドリンの調整
[編集]プソイドエフェドリンの2つのエナンチオマーは市販されている。ラセミ体の塩酸塩は、Sudafedという商品名で、内服用の鼻づまり治療薬としてアメリカで市販されている。プソイドエフェドリンは、覚醒剤であるメタンフェタミンの原料となるため、学術的および工業的な購入・使用がきわめて制限されているという問題点がある。代替化合物として、ハーバード大学のアンドリュー・マイヤーのグループは、プソイドエフェナミンを不斉補助剤として用いて、不斉アルキル化反応を行うことに成功している[26]。プソイドエフェナミンは市販されていない試薬であるが、法的制限のない化合物を原料として合成することができる。
アルキル化
[編集]プソイドエフェドリンアミドにリチウムジイソプロピルアミド(LDA)のような強塩基を作用させると、α-水素の引き抜きによってZ体のリチウムエノラートが生成する。このリチウムエノラートは高い面選択性でアルキル化を受ける。

このジアステレオ選択性は、リチウムエノラートの一方の面が第二級リチウムアルコキシドおよびそのリチウム原子に配位している溶媒分子によって遮蔽された立体配座を取ることによって生じると考えられている。この考えに従い、テトラヒドロフランのような配位性溶媒を用いて、塩化リチウムを当量添加すると、ジアステレオ選択性は向上する。

プソイドエフェドリンを不斉アルキル化反応の不斉補助剤として用いる利点として、アミドエノラートの求核性が比較的高く、−78℃から0℃という幅広い温度範囲にて第一級、第二級ハロゲン化アルキルと容易に反応することが挙げられる。α-分枝アミドエノラートの求核反応による第四級不斉炭素の構築も可能である。ただし、求核性を向上させるためにDMPUを添加する必要がある。[27]
除去
[編集]プソイドエフェドリンアミドは、カルボン酸、アルコール、アルデヒド、ケトンなど様々な官能基を持ったキラル化合物に変換できる。

tert-ブタンスルフィンアミド
[編集]
カリフォルニア大学バークレー校のジョナサン・エルマンは、tert-ブタンスルフィンアミドを不斉補助剤として用いることを報告した[28]。
調製
[編集]tert-ブタンスルフィンアミドの2つのエナンチオマーは、ジ-tert-ブチルジスルフィドから次の2段階の工程を経て得られる。まず、ジ-tert-ブチルジスルフィドの片方のチオエーテル部分の触媒的不斉酸化反応を行う。次に、アンモニア、リチウムアミドで処理することにより、硫黄原子の立体化学の反転を伴って目的の化合物を得ることができる。

tert-ブタンスルフィンアミドとアルデヒドおよびケトンとの縮合反応により、対応するE体のイミンが得られる。

キラルなアミンの合成
[編集]縮合反応により得られたイミンにグリニャール試薬を添加することにより、不斉付加反応が起き、分枝構造を持つキラルなスルフィンアミドが生成する。この立体選択性は六員環遷移状態を想定することで説明できる。

除去
[編集]不斉補助剤は、プロトン性溶媒下で塩酸処理を行うことにより除くことができ、対応するアミンが生成する。

SAMP/RAMP
[編集](S)-1-アミノ-2-メトキシメチルピロリジン(SAMP)および(R)-1-アミノ-2-メトキシメチルピロリジン(RMAP)のヒドラゾン化合物は、イライアス・コーリーらによって開発された不斉補助剤である[29][30]。
調製
[編集]SAMPはL-プロリンから6段階、RAMPはD-グルタミン酸から6段階のステップを経て合成される。

アルキル化反応
[編集]SAMPおよびRAMPとアルデヒドまたはケトンの縮合反応により、E体のヒドラジン化合物が生成する。この化合物にリチウムジイソプロピルアミドを加えてプロトンを引き抜き、求電子剤としてハロゲン化アルキルを加えると、イミンのα位がジアステレオ選択的にアルキル化された生成物が得られる。不斉補助剤は、オゾン分解または酸加水分解により分離することができる。

工業的に利用されている不斉補助剤
[編集]不斉補助剤を用いた不斉合成は、短時間で数々のエナンチオピュアな化合物を得ることができるため、便利であり信頼できる手法である。したがって不斉補助剤は、医薬品開発の初期段階において頻繁に用いられてきた[2]。
チプラナビル
[編集]HIVプロテアーゼ阻害剤であるチプラナビル(英語版)は、抗HIV薬として流通している。チプラナビルの合成において最初に用いられた合成経路は、キラルなマイケル受容体への有機クプラートの共役付加反応を含んでいる[31]。マイケル受容体に結合した不斉補助剤であるオキサゾリジノンによって、分子内に2つ存在する不斉炭素の内の1つの立体化学をコントロールできる。ただし、現在はこのような経路でチプラナビルの合成は行われておらず、実際は不斉水素化(英語版)によって不斉中心が導入される[32]。

アトルバスタチン
[編集]アトルバスタチンのカルシウム塩は、「リピトール」という商品名で、高コレステロール血症治療薬として流通している。最初に用いられた合成経路では、2つのアルコール部分の不斉中心の内の1つは、不斉補助剤によるキラルなエステルのジアステレオ選択的なアルドール反応によって構築されていた[33]。現在は、エリソルビン酸より不斉中心が導入されている[34]。

脚注
[編集]- ^ Key Chiral Auxiliary Applications (Second Edition)(ed.: Roos, G.), Academic Press, Boston, 2014. ISBN 978-0-12-417034-6.
- ^ a b c Glorius, F.; Gnas, Y. (2006). “Chiral Auxiliaries — Principles and Recent Applications”. Synthesis 12: 1899–1930. doi:10.1055/s-2006-942399.
- ^ Jamali, Fakhreddin (1993). “Chapter 14: Stereochemically Pure Drugs: An Overview”. In Wainer, Irving W.. Drug Stereochemistry: Analytical Methods and Pharmacology. Marcel Dekker, Inc.. pp. 375–382. ISBN 0-8247-8819-2
- ^ a b Evans, D. A.; Helmchen, G.; Rüping, M. (2007). “Chiral Auxiliaries in Asymmetric Synthesis”. In Christmann, M. Asymmetric Synthesis — The Essentials. Wiley-VCH Verlag GmbH & Co.. pp. 3–9. ISBN 978-3-527-31399-0
- ^ a b Corey, E. J.; Ensley, H. E. (1975). “Preparation of an Optically Active Prostaglandin Intermediate via Asymmetric Induction”. J. Am. Chem. Soc. 97 (23): 6908–6909. doi:10.1021/ja00856a074.
- ^ Nicolau, K. C. (2008). Classics in Total Synthesis (5th ed.). New York, New York: Wiley-VCH. pp. 485–508. ISBN 978-3-527-29231-8
- ^ Miller, J. P. (2013). “ChemInform Abstract: Recent Advances in Asymmetric Diels-Alder Reactions”. ChemInform 44 (48). doi:10.1002/chin.201348243.
- ^ Corey, E. J.; Ensley, H. E.; Parnell, C. A. (1978). “Convenient Synthesis of a Highly Efficient and Recyclable Chiral Director for Asymmetric Induction”. J. Org. Chem. 43 (8): 1610–1611. doi:10.1021/jo00402a037.
- ^ Whitesell, J. K.; Chen, H. H.; Lawrence, R. M. (1985). “trans-2-Phenylcyclohexanol. A powerful and readily available chiral auxiliary”. J. Org. Chem. 50 (23): 4663–4664. doi:10.1021/jo00223a055.
- ^ Comins, D. L; Salvador, J. D. (1993). “Efficient Synthesis and Resolution of trans-2-( 1-Aryl-1-methylethyl)cyclohexanols: Practical Alternatives to 8-P henylmenthol”. J. Org. Chem. 58 (17): 4656–4661. doi:10.1021/jo00069a031.
- ^ Brunel, Jean Michel. “BINOL: A Versatile Chiral Reagent”. Chemical Reviews 105 (3): 857–898. doi:10.1021/cr040079g.
- ^ a b Sakane, Soichi; Fujiwara, Junya; Maruoka, Keiji; Yamamoto, Hisashi. “Chiral leaving group. Biogenetic-type asymmetric synthesis of limonene and bisabolenes”. Journal of the American Chemical Society 105 (19): 6154–6155. doi:10.1021/ja00357a033.
- ^ Tanaka, Kiyoshi; Ahn, Mija; Watanabe, Yukari; Fuji, Kaoru (1996-06-01). “Asymmetric synthesis of uncommon α-amino acids by diastereoselective alkylations of a chiral glycine equivalent”. Tetrahedron: Asymmetry 7 (6): 1771–1782. doi:10.1016/0957-4166(96)00212-1.
- ^ Maglioli, Paola; De Lucchi, Ottorino; Delogu, Giovanna; Valle, Giovanni (1992-01-01). “Highly diastereoselective reduction and addition of nucleophiles to binaphthol-protected arylglyoxals”. Tetrahedron: Asymmetry 3 (3): 365–366. doi:10.1016/S0957-4166(00)80276-1.
- ^ Buchi, George; Vogel, Dennis E.. “A new method for the preparation of .gamma.,.delta.-unsaturated ketones via Claisen rearrangement”. The Journal of Organic Chemistry 50 (23): 4664–4665. doi:10.1021/jo00223a056.
- ^ Miller, Aubry K.; Hughes, Chambers C.; Kennedy-Smith, Joshua J.; Gradl, Stefan N.; Trauner, Dirk. “Total Synthesis of (−)-Heptemerone B and (−)-Guanacastepene E”. Journal of the American Chemical Society 128 (51): 17057–17062. doi:10.1021/ja0660507.
- ^ Al Hazmi, Ali M.; Sheikh, Nadeem S.; Bataille, Carole J. R.; Al-Hadedi, Azzam A. M.; Watkin, Sam V.; Luker, Tim J.; Camp, Nicholas P.; Brown, Richard C. D.. “trans -2-Tritylcyclohexanol as a Chiral Auxiliary in Permanganate-Mediated Oxidative Cyclization of 2-Methylenehept-5-enoates: Application to the Synthesis of trans -(+)-Linalool Oxide”. Organic Letters 16 (19): 5104–5107. doi:10.1021/ol502454r.
- ^ a b Evans, D. A.; Bartroli, J.; Shih, T. L (1981). “Enantioselective aldol condensations. 2. Erythro-selective chiral aldol condensations via boron enolates”. J. Am. Chem. Soc. 103 (8): 2127–2129. doi:10.1021/ja00398a058.
- ^ a b Evans, D. A.; Ennis, M D.; Mathre, D. J. (1982). “Asymmetric Alkylation Reactions of Chiral Imide Enolates. A Practical Approach to the Enantioselective Synthesis of a-Substituted Carboxylic Acid Derivatives”. J. Am. Chem. Soc. 104 (6): 1737–1739. doi:10.1021/ja00370a050.
- ^ Evans, D. A.; Chapman, K. T.; Bisaha, J. (1984). “New Asymmetric Diels-Alder Cycloaddition Reactions. Chiral α,β-Unsaturated Carboximides as Practical Chiral Acrylate and Crotonate Dienophile Synthons”. J. Am. Chem. Soc. 106 (15): 4261–4263. doi:10.1021/ja00327a031.
- ^ Evans, D. A.; Chapman, K. T.; Hung, D. T.; Kawaguchi, A. T. (1987). “Transition State π-Solvation by Aromatic Rings: An Electronic Contribution to Diels-Alder Reaction Diastereoselectivity”. Angew. Chem. Int. Ed. 26 (11): 1184–1186. doi:10.1002/anie.198711841.
- ^ Shinada, Tetsuro; Oe, Kentaro; Ohfune, Yasufumi (2012-06-27). “Efficient total synthesis of manzacidin B”. Tetrahedron Letters 53 (26): 3250–3253. doi:10.1016/j.tetlet.2012.04.042.
- ^ Tsai, Wen-Jiuan; Lin, Yi-Tsong; Uang, Biing-Jiun (1994-07-01). “Asymmetric Michael addition of thiols to (1R,2R,4R)-(−)-2,10-N-enoylcamphorsultam”. Tetrahedron: Asymmetry 5 (7): 1195–1198. doi:10.1016/0957-4166(94)80155-X.
- ^ Takao, Ken-ichi; Sakamoto, Shu; Touati, Marianne Ayaka; Kusakawa, Yusuke; Tadano, Kin-ichi (2012-11-08). “Asymmetric Construction of All-Carbon Quaternary Stereocenters by Chiral-Auxiliary-Mediated Claisen Rearrangement and Total Synthesis of (+)-Bakuchiol” (英語). Molecules 17 (11): 13330–13344. doi:10.3390/molecules171113330.
- ^ Myers, A. G., et al., Pseudoephedrine as a Practical Chiral Auxiliary for the Synthesis of Highly Enantiomerically Enriched Carboxylic Acids, Alcohols, Aldehydes, and Ketones, J. Am. Chem. Soc., 1997, 119, 6496-6511.doi:10.1021/ja970402f
- ^ Myers, A. G.; Morales, M. R.; Mellem, K. T. (2012). “Pseudoephenamine: A Practical Chiral Auxiliary for Asymmetric Synthesis”. Angew. Chem. 124: 4646–4649. doi:10.1002/ange.201200370.
- ^ Kummer, D. A.; Chain, W. J.; Morales, M. R.; Quiroga, O.; Myers, A. G. (2008). “Stereocontrolled Alkylative Construction of Quaternary Carbon Centers”. J. Am. Chem. Soc. 130: 13231–13233. doi:10.1021/ja806021y.
- ^ Ellman, J. A.; Owens, T. D.; Tang, T. P. (2002). “N-tert-Butanesulfinyl Imines: Versatile Intermediates for the Asymmetric Synthesis of Amines”. Acc. Chem. Res. 35: 984–995. doi:10.1021/ar020066u.
- ^ Corey, E. J.; Enders, D. (1976). “Applications of N,N-dimethylhydrazones to synthesis. Use in efficient, positionally and stereochemically selective C-C bond formation; oxidative hydrolysis to carbonyl compounds”. Tetrahedron Letters 17 (1): 3–6. doi:10.1016/s0040-4039(00)71307-4.
- ^ Kurti, L.; Czako, B. (2005). Strategic Applications of Named Reactions in Organic Synthesis. Burlington, MA: Elsevier Academic Press. pp. 150–151. ISBN 0-12-369483-3
- ^ Turner, S. T. (1998). “Tipranavir (PNU-140690): A Potent, Orally Bioavailable Nonpeptidic HIV Protease Inhibitor of the 5,6-Dihydro-4-hydroxy-2-pyrone Sulfonamide Class”. J. Med. Chem. 41: 3467–3476. doi:10.1021/jm9802158.
- ^ Caron, Stéphane (2011). “Chapter 15: Synthetic Route Development of Selected Contemporary Pharmaceutical Drugs”. In Caron, Stéphane. Practical Synthetic Organic Chemistry. John Wiley & Sons, Inc.. pp. 666–670. ISBN 978-0-470-03733-1
- ^ Roth, B. D. ' (1991). “Inhibitors of Cholesterol Biosynthesis. 3. Tetrahydro-4-hydroxy-6-[2-( lH-pyrrol-l-yl)ethyl]-2H-pyran-2-one Inhibitors of HMG-CoA Reductase. 2. Effects of Introducing Substituents at Positions Three and Four of the Pyrrole Nucleus”. J. Med. Chem. 34: 357–366. doi:10.1021/jm00105a056.
- ^ Jie Jack Li, Douglas S. Johnson, Drago R. Sliskovic, Bruce D. Roth (2004). “Chapter 9. Atorvastatin Calcium (Lipitor)”. Contemporary Drug Synthesis. John Wiley & Sons, Inc.. pp. 113–125. ISBN 0-471-21480-9
| 用語 | |
|---|---|
| 分析 | |
| 光学分割 | |
| 反応 | |
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
