巴布勒氧化
Babler氧化反应(英语:Babler oxidation)也称作Babler-Dauben氧化反应,是一种使用吡啶氯铬酸盐(PCC)直接转化烯丙基叔醇为相应的α,β-不饱和羰基化合物的有机反应[1]。
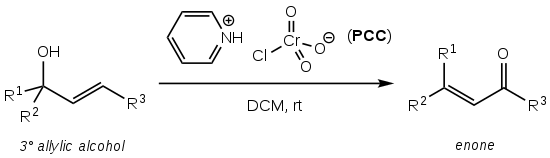
詹姆斯·巴布勒(J. H. Babler)和威廉·道本(W. G. Dauben)分别于1976和1977年报道了这一反应[1][2],并将此反应拓展至环状体系中[1][3],使该反应具有了一定的合成实用性,该反应也以他们二人命名。

该反应的目标α,β-不饱和醛酮产率较高(通常大于75%),操作简便也无需气体保护或加热[1],但所使用的六价铬氧化剂PCC具有很高的毒性、致癌性和环境危险性。
该反应的溶剂通常是干燥的二氯甲烷(DCM)或氯仿(CHCl3)[1][2]。该反应为吗啡全合成中的一步[1][4]。
机理
[编辑]据报道叔醇的Babler氧化反应机理是由烯丙基醇亲核进攻铬酸盐,形成铬酸酯(1),然后经过[3,3]-σ迁移重排成异构的铬酸酯(2)并最终氧化得到α,β-不饱和醛酮(3)[1]。

环保改进
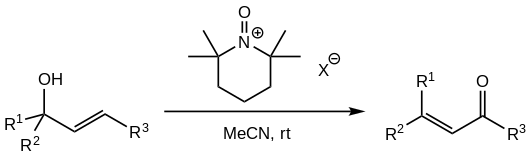
[编辑]由于PCC氧化剂的高毒性和致癌性,并考虑到铬(VI)对地下水污染的作用,有研究尝试在类似反应中替代PCC。有报道成功使用TMP衍生的N-氧代铵盐进行替代。[1][5] 替代的氧代铵盐仅可使用带有非配位阴离子的(如四氟硼酸盐、高氯酸盐、六氟磷酸盐或六氟锑酸盐)[5],氧化剂按化学计量使用,通常为醇的1.5 eq。
另一种方法是减少反应中铬(VI)的使用量,如只使用催化量的PCC(5 mol%)和过量的另一种氧化剂作为共氧化剂(co-oxidant)进行反应,此法中已见报告的试剂有二叔丁基过氧化物、2-碘酰基苯甲酸或高碘酸[1]。
对仲醇的氧化
[编辑]相较于叔醇,烯丙基仲醇的Babler-Dauben氧化反应更难控制,会出现裂解的副产物(c)[1]:
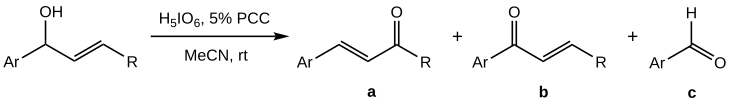
据报道,当PCC不按化学计量投入,而是作为共氧化剂使用时,a的产率将最大化;如果以高碘酸作为主要氧化剂、5 mol%的PCC作为共氧化剂时,效果最好(a产率达50-70%),溶剂选择乙腈[1]。
与叔醇不同的是,仲醇的Babler氧化只发生在芳基底物(Ar-)或含杂环芳香的结构上,并且考虑到反应中使用的过量高碘酸导致的强酸性条件,仲醇氧化的反应机理被认为是未经过σ迁移重排,而是经由碳正离子中间体进行的。[1]
参见
[编辑]参考文献
[编辑]- ^ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 Killoran, Patrick M.; Rossington, Steven B.; Wilkinson, James A.; Hadfield, John A. Expanding the scope of the Babler–Dauben oxidation: 1,3-oxidative transposition of secondary allylic alcohols. Tetrahedron Letters. 2016-08-31, 57 (35): 3954–3957. ISSN 0040-4039. doi:10.1016/j.tetlet.2016.07.076 (英语).
- ^ 2.0 2.1 Babler, James H.; Coghlan, Michael J. A Facile Method for the Bishomologation of Ketones to α,β-Unsaturated Aldehydes: Application to the Synthesis of the Cyclohexanoid Components of the Boll Weevil Sex Attractant. Synthetic Communications. 1976-01-01, 6 (7): 469–474. ISSN 0039-7911. doi:10.1080/00397917608082626.
- ^ Dauben, William G.; Michno, Drake M. Direct oxidation of tertiary allylic alcohols. A simple and effective method for alkylative carbonyl transposition. The Journal of Organic Chemistry. 1977-03-01, 42 (4): 682–685. ISSN 0022-3263. doi:10.1021/jo00424a023.
- ^ Nagata, Hiroshi; Miyazawa, Norio; Ogasawara, Kunio. A concise route to (−)-morphine. Chemical Communications. 2001-01-01, (12): 1094–1095 [2023-07-25]. ISSN 1364-548X. doi:10.1039/B101668G. (原始内容存档于2023-07-25) (英语).
- ^ 5.0 5.1 Shibuya, Masatoshi; Tomizawa, Masaki; Iwabuchi, Yoshiharu. Oxidative Rearrangement of Tertiary Allylic Alcohols Employing Oxoammonium Salts. The Journal of Organic Chemistry. 2008-06-01, 73 (12): 4750–4752. ISSN 0022-3263. PMID 18500838. doi:10.1021/jo800634r.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
