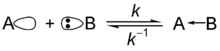盐基

盐基或碱基,有时也称做碱[1](尽管“碱”具有多种意义)。这是根据布仑斯惕-劳里学说关于酸和盐基的部分,盐基可以简单想像成吸收质子的物质。额外的定义包括提供孤立电子对(由吉尔伯特·路易斯提出),以及是氢氧根离子的来源(由阿伦尼乌斯提出)。这三种定义下,盐基都是会和酸反应的物质,符合纪尧姆-弗朗索瓦·鲁埃勒在18世纪中提出的概念。
阿伦尼乌斯盐基可以影响水的自电离化学平衡,让氢离子的活性度比在纯水中要低,因此,在标准状态 下的pH值会大于7.0。可溶于水的盐基若含有OH−,且会释放相当量的OH−离子,即为碱。氧化物、氢氧化物、醇盐都是碱性,而弱酸的共轭酸碱对也是较弱的盐基。酸和盐基的化学作用恰好相反,酸会增加水中的水合氢离子(H3O+)浓度,盐基则会减少水合氢离子浓度。酸和盐基在水溶液中的反应称为中和反应,会产生水以及盐。若水溶液已经饱和,就会有盐类的沉淀。
盐基的定义
[编辑]法国化学家纪尧姆-弗朗索瓦·鲁埃勒于1754年制定了盐基这一概念。他注意到当时的酸大多是挥发性液体(例如乙酸),与特定物质化合便会转变为固态盐。这些特定物质便是盐的“根基”[2]并因此得名。碱是盐基的一个特殊例子,会在水溶液中释出氢氧根离子。阿伦尼乌斯盐基是指水溶而水溶液pH值经常大于7的盐基。这些氢氧化物的水溶液也有一些共通的特性,触感具黏滑和像肥皂的感觉,味道有苦味[3],也可以让酸碱指示剂变色(例如让红色石蕊试纸变蓝色)。阿伦尼乌斯盐基(Arrhenius base)是氢氧根离子的来源。
- NaOH → Na+ + OH−
在更广义的酸碱质子理论(1923年)中,布仑斯惕盐基是可以接受氢正离子(H+,当时称为质子)的物质。此定义包括了氢氧化物的水溶液,因为OH−会和H+反应,形成水,因此阿伦尼乌斯盐基也属于布仑斯惕盐基,不过也有其他的不含氢氧根的布仑斯惕盐基,例如氨(NH3)或是胺的水溶液[4],也会接受氢正离子,而且本身也会和水反应,增加水中氢氧根的浓度[5]。也有一些无机非水溶剂中包括布仑斯惕盐基,会和溶剂化的质子反应,例如液氨中的NH2−就是盐基离子,会接受NH4+的质子。布仑斯惕盐基(Brønsted base)是指吸收质子的物质,下式中B−为盐基:
- B + H+ → B+H
- B− + H+ → BH
吉尔伯特·路易斯明了水、氨和其他盐基会和质子结合的原子是因为盐基中有的孤电子对[5]。在酸碱电子理论中,路易斯盐基是指可提供电子对的物质,可以提供一对电子给电子对接受者(路易斯酸)[6]。路易斯理论比布仑斯惕理论更通用。路易士盐基(Lewis base)是孤立电子对的提供者,下式中B为盐基:
盐基和pH值
[编辑]量度(不纯的)水的pH值,便是测试它的酸性。纯水中,大约每千万个水分子便有一个根据以下方程式电离为水合氢离子和氢氧根离子:
- 2H2O(l) → H3O+(aq) + OH−(aq)
浓度即是以摩尔浓度计算(M或摩尔每立方分米(mol/ dm3))水合氢离子和氢氧根离子的浓度;是为水的离解常数,数值为10−7 M。pH值定义为−log [H3O+];因此,纯水的pH值是7。(这些数据均取于23 °C,并于不同温度时有所差别。)
盐基接收(或去除)溶液中的水合氢离子,或释放氢氧根离子到溶液中。两者均降低了水合氢离子在水中的浓度,从而提升pH值。相反,酸释放水合氢离子或接收氢氧根离子而降低pH值。
例如,1摩尔的氢氧化钠(40 克)溶于1升的水中,氢氧根离子的浓度便是1摩尔每升。所以氢离子浓度为每升[H+] = 10−14 摩尔,而pH值 = −log 10−14 = 14.
碱度系数(pKb)是碱性的测量,并和酸度系数(pKa)有以下关系pKa + pKb = 14.
碱浓度是量度溶液相对碳酸盐或碳酸氢盐中和酸的能力。
与酸的中和作用
[编辑]当盐基溶解于水中,氢氧化钠离解为氢氧根离子和钠离子:
- NaOH → Na+ + OH−
同样地,氯化氢于水中生成水合氢离子和氯离子:
- HCl + H2O → H3O+ + Cl−
当两种溶液混合,水合氢离子(H3O+)和氢氧根离子(OH−)化合生成水分子:
- H3O+ + OH− → 2 H2O
如果以相同分量的氢氧化钠溶液和氢氯酸混合,盐基和酸会恰好完全中和,于溶液中生成氯化钠,即食盐。
弱盐基,如苏打和蛋白,用于酸泄漏事件中的中和剂。以强盐基如氢氧化钠或氢氧化钾中和会引起剧烈的放热反应,同时盐基也制造了和酸泄漏同等的破坏。
非金属氧化物的碱性
[编辑]碳酸钠和氨亦是盐基,但它们都没有氢氧根离子(OH−)。这是因为两种都在溶解时接收氢离子(H+):
- Na2CO3 + H2O → 2 Na+ + HCO3− + OH−
- NH3 + H2O → NH4+ + OH−
盐基的强弱
[编辑]强盐基是一种会完全水解的盐基,并提升pH值到14或以上。强盐基,像强酸一样,会侵袭生物组织并引致灼伤。它们的反应不同,所以强酸具腐蚀性,而强盐基则是苛性的。超强盐基是一类特别的碱性化合物而非亲核碱(暂无译名)是一类缺少亲核性的特殊强盐基。而弱盐基包括用于清洁的氨。
强盐基
[编辑]强盐基是碱性化合物所以能够以酸碱反应将弱盐基去质子化。酸度系数大于及等于13的化合物都称为强盐基。常见例子包括碱金属和碱土金属的氢氧化物如氢氧化钠及氢氧化钙。非常强的盐基甚至能在缺少水时将微酸性的烃去质子化。
以下是一些氢氧化物的强盐基:
这些金属的阳离子出现于元素周期表的第1和第2族上(即碱金属和碱土金属)。
第1族的碳阴离子,氨基以及氢化物盐由于共轭酸而趋向成为更强的盐基,能于烃、氨基和水中稳定。[来源请求]
路易士盐基
[编辑]酸碱电子理论中的路易士盐基,也称为电子对提供者,是有高能量电子对的分子,可以和有低能级空电子轨道的分子共享电子对,形成加成物。电子对接收者除了H+外,也包括一些中性分子(例如BF3)或金属离子(例如Ag+或Fe3+)。包括金属离子的加成物一般会用配合物来表示[7]。
依照吉尔伯特·路易斯原始的叙述,若中性的盐基和中性的酸产生了键结,会有电子应力[8]。盐基和酸会共享原来盐基上的电子对[8],因此会产生很大的偶极矩,只有重组分子才能破坏偶极矩[8]。
盐基作为异构催化剂
[编辑]碱性物质可用作化学反应的异构不可溶催化剂。例如氧化镁,氧化钙以及氧化钡等金属氧化物以及氧化铝上的氟化钾和某几种沸石。大量过渡金属化合物是良好催化剂,其中不少是碱性的。碱性催化剂可用于氢化、双键的移动、米尔温–庞多夫–韦尔莱还原反应、迈克尔反应等反应。氧化钙或氧化镁若在高温下都是高活性的催化剂[9]。
盐基和碱的混淆
[编辑]盐基(base)和碱(alkali)这两个术语交换使用,这是由于大部分的碱都是盐基。而金属氧化物及金属氢氧化物都是归纳为盐基。“测量泥土中的碱性”实际是量度pH值。
注意不是大部分碱金属盐都是碱,只有本身是碱性的盐才是碱。
尽管大部分电阳的金属氧化物都是碱性,只有可溶的碱金属及碱土金属氧化物才可称为碱。
碱是碱金属及碱土金属的碱性盐,但根据辞典,对碱的定义却有相矛盾[10][11],包括:
不可溶于水的例子
[编辑]- 氧化铜等大部分金属氧化物
可溶于水的例子
[编辑]注释
[编辑]- ^ 大英百科全书线上繁体中文版[永久失效链接]
- ^ The Origin of the Term Base William B. Jensen Journal of Chemical Education · 1130第83卷,2006年8月8日
- ^ Johlubl, Matthew E. Investigating chemistry: a forensic science perspective 2nd. New York: W. H. Freeman and Co. 2009. ISBN 978-1429209892. OCLC 392223218.
- ^ Whitten et al. (2009),第363页.
- ^ 5.0 5.1 Zumdahl & DeCoste (2013),第257页.
- ^ Whitten et al. (2009),第349页.
- ^ Miessler, Gary L.; Tarr, Donald A. Inorganic Chemistry 2nd. Prentice-Hall. 1999: 157–159. ISBN 0-13-841891-8.
- ^ 8.0 8.1 8.2 Lewis, Gilbert N. Acids and Bases. Journal of the Franklin Institute. September 1938, 226 (3): 293–313 [3 September 2020]. doi:10.1016/S0016-0032(38)91691-6. (原始内容存档于2021-11-02).
- ^ Tanabe, K.; Misono, M.; Ono, Y.; Hattori, H. New Solid Acids and Bases: their catalytic properties. Elsevier. 1990: 14 [19 February 2015]. ISBN 9780080887555. (原始内容存档于2021-09-29).
- ^ the definition of alkali in Englsh wiktionary. [2006-08-03]. (原始内容存档于2006-09-13).
- ^ the difinition of alkali in dictionary.com. [2006-08-03]. (原始内容存档于2009-03-05).
- ^ The difinition of Alkali in tiscali reference. [2006-05-23]. (原始内容存档于2006-05-23).
- ^ The definition of alkali in thefreedictionary. [2007-03-11]. (原始内容存档于2006-08-31).
- ^ Acids, Bases and Salts -krysstal. [2006-08-03]. (原始内容存档于2006-08-13).
- Whitten, Kenneth W.; Peck, Larry; Davis, Raymond E.; Lockwood, Lisa; Stanley, George G. Chemistry
 9th. 2009. ISBN 978-0-495-39163-0.
9th. 2009. ISBN 978-0-495-39163-0. - Zumdahl, Steven; DeCoste, Donald. Chemical Principles 7th. Mary Finch. 2013.
参见
[编辑]
|
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.