Реакція Дільса — Альдера
Матеріал з Вікіпедії — вільної енциклопедії.
| Реакція Дільса — Альдера | |
| Названо на честь | Отто Пауль Герман Дільс і Курт Альдер |
|---|---|
| | |

Реа́кція Ді́льса — А́льдера — реакція циклоприєднання між спряженим дієном та заміщеним алкеном (що також називається дієнофілом) що призводить до утворення заміщених циклогексенів.[1][2][3] Реакція проходить також у тому випадку, коли деякі атоми в новоутвореному циклі не є атомами вуглецю. У деяких випадках реакція Дільса — Альдера може протікати у зворотному напрямку і називається реакцією ретро-Дільса — Альдера. Отто Дільс та Курт Альдер вперше повідомили про цю реакцію у 1928 році, за що у 1950 році були нагороджені Нобелівською премією з хімії.
Реакція Дільса — Альдера належить до так званих перициклічних реакцій. Перициклічні реакції, в результаті яких утворюються циклічні сполуки, називаються реакціями циклоприєднання. Існує багато різновидів реакцій циклоприєднання, одним з найпоширеніших є [4+2]-циклоприєднання, де ключовим етапом є узгоджена взаємодія 4π-електронів дієну і 2π-електронів дієнофілу, що знаходяться на вищій зайнятій (HOMO) і нижній вільній (LUMO) молекулфрних орбіталях сполук.[4] Ця реакція проходить порівняно легко, зважаючи на те, що перехідний стан містить шестичленну π-електронну ароматичну структуру, котра знижує енергію активації.

Дієновий компонент реакції Дільса — Альдера може бути як відкритим ланцюгом, так і циклічним та містити різноманітні замісники.[5]. Проте існує обмеження: дієн повинен існувати в s-цис конформації. Циклічні дієни, котрі постійно перебувають у s-цис конформації, є винятково активними в даній реакції (наприклад, циклопентадієн), у той час як циклічні дієни, котрі можуть перебувати лише в s-транс конформації, в реакцію Дільса — Альдера взагалі не вступають. Особливо реакційноздатним є дієн Данішефського (1-метокси-3-триметилсилілокси-1,3-бутадієн)[6] та схожі дієни з замісниками при C1 та C3. Їх підвищена реакційна здатність обумовлена підняттям енергії HOMO орбіталі (найвищої зайнятої молекулярної орбіталі) дієну.[7]

Надзвичайно високореакційними є також є нестабільні дієни, які можна отримати тільки як проміжні сполуки (in situ) і які стабілізуются через утворення аромаичного кільця при циклоприєднанні.[8]
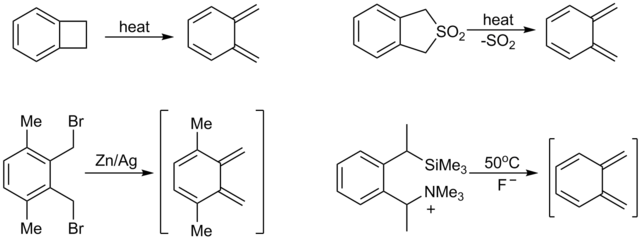
Бензеноїдні сполуки рідко піддаються реакції Дільса — Альдера і часто вимагають дуже активних дієнофілів. Одним з прикладів такої рідкісної реакції є реакція Ваґнера-Яуреґґа.[9][10]
Як правило, у реакції Дільса — Альдера дієнофіл має електроноакцепторну групу, спряжену із алкеном. Проте активніші дієнофіли повинні бути сильніше спряжені, як мінімум з фенільною групою або з атомом хлору. Дієнофіл може бути активований також кислотою Льюїса, наприклад пентахлоридом ніобію.[11]
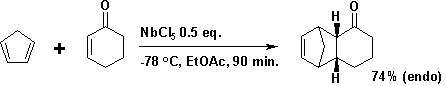
Див. Регіоселективність
Реакція Дільса — Альдера між несиметричними сполуками може приводити до двох різних продуктів. При різній електронодонорності замісників відбувається розподіл зарядів у молекулах дієну та дієнофілу, що впливає на відносну кількість двох можливих продуктів.[12]

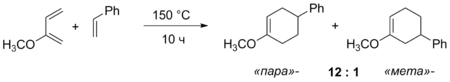
Див. також Стереоселективність
Оскільки реакція Дільса — Альдера це узгоджений проецес перерозподілу електронної густини через циклічний перехідний стан, то конфігурація продукту визначається конфігурацією реагентів. Так, з(Z)-алкенів утворюються цис-продукти, а з (E)-алкенів — транс-продукти[12]. Аналогічним чином можна визначити і орієнтацію замісників дієну в продукті циклоприєднанняи[13]:
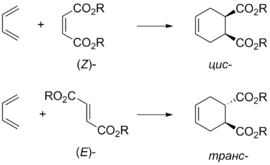
|
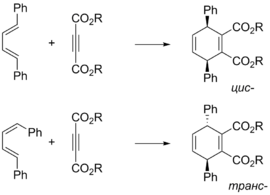
|
- Глосарій термінів з хімії / укладачі: Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- ↑ Diels, O.; Alder, K. (1928). «Synthesen in der hydroaromatischen Reihe». Justus Liebig's Annalen der Chemie 460: 98. doi:10.1002/jlac.19284600106.
- ↑ Synthesis of the hydro aromatic sequence, Ann. 1929, 470, 62.
- ↑ Synthesis in the hydroaromatic series, IV. Announcement: The rearrangement of malein acid anhydride on arylated diene, triene and fulvene, Diels, O.; Alder, K. Ber. 1929, 62, 2081 & 2087.
- ↑ Dewar, MJ; Olivella, S; Stewart, JJ (1986). Mechanism of the Diels-Alder reaction: Reactions of butadiene with ethylene and cyanoethylenes. J. Am. Chem. Soc. 108 (19): 5771—9. doi:10.1021/ja00279a018. PMID 22175326.
- ↑ Kozmin, S. A.; He, S.; Rawal, V. H. Organic Syntheses, Coll. Vol. 10, p.442 (2004); Vol. 78, p.160 (2002). (Article)
- ↑ Danishefsky, S.; Kitahara, T. (1974). Useful diene for the Diels-Alder reaction. J. Am. Chem. Soc. 96 (25): 7807. doi:10.1021/ja00832a031.
- ↑ Nicolaou, K. C.; Snyder, Scott A.; Montagnon, Tamsyn; Vassilikogiannakis, Georgios (2002). The Diels-Alder Reaction in Total Synthesis. Ang. Chem. Int. Ed. 41 (10): 1668. doi:10.1002/1521-3773(20020517)41:10<1668::AID-ANIE1668>3.0.CO;2-Z.
- ↑ Klundt, Irwin L. (1970). Benzocyclobutene and its derivatives. Chem. Rev. 70 (4): 471. doi:10.1021/cr60266a002.
- ↑ Theodor Wagner-Jauregg (1930). Über addierende Hetero-polymerisation. Ber. 68 (11): 3218. doi:10.1002/cber.19300631140.
- ↑ Theodor Wagner-Jauregg (1931). Die Addition von Maleinsäureanhydrid an asymm. Diphenyl-äthylen. Ann. 491: 1. doi:10.1002/jlac.19314910102.
- ↑ ^ Niobium Pentachloride Activation of Enone Derivatives: Diels-Alder and Conjugate Addition Products Mauricio Gomes Constantino, Valdemar Lacerda Júnior and Gil Valdo José da Silva Molecules 2002, 7, 456–465. (Article)
- ↑ а б Смит, Дильман, часть 1, 2009, с. 612—618.
- ↑ Зауэр Е. Механизм реакции Дильса — Альдера // Успехи химии. — 1969. — Т. 38, № 4. — С. 624—661.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
