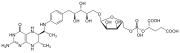
Tetrahydrometánopterín
| Tetrahydrometánopterín | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C30H45N6O16P |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 776,682661 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 92481-94-2 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Tetrahydrometánopterín (THMPT, H4MPT) je koenzým vystupujúci v metanogenéze. Je to nosič jednouhlíkovej skupiny, ktorá sa redukuje na metylovú skupinu pred prenosom na koenzým M.[1]
Tetrahydrosarcinapterín (THSPT, H4SPT) je modifikovaná forma THMPT, kde je na 2-hydroxyglutarátový koniec naviazaná glutamylová skupina.
Redukcia C1 skupín
[upraviť | upraviť zdroj]N-Formylmetánofurán funguje ako donor C1 skupiny na N5 pterínu, čím vzniká formyl-THMPT.[2] Táto formylová skupina potom interamolekulárne kondenzuje, čím vzniká metenyl-THMPT+, ktorý sa potom redukuje na metylén-THMPT.[3] Metylén-THMPT sa následne premieňa na metyl-THMPT. V tejto reakcii vystupuje ako zdroj elektrónov koenzým F420 a reakciu katalyzuje F420-dependentná metylén-THMPT reduktáza. Metyl-THMPT potom funguje ako donor metylovej skupiny na koenzým M, čo je reakcia katalyzovaná metyl-THMPT koenzým M metyltransferázou.[1]
Porovnanie s tetrahydrofolátom
[upraviť | upraviť zdroj]THMPT je príbuzný tetrahydrofolátu (THFA, H4FA). Najdôležitejším rozdiel medzi THMPT a THFA je, že THFA má vedľa fenylového kruhu karbonylovú skupinu, ktorá odťahuje elektróny. Kvôli tomu je redukcia metenyl-THMPT v porovnaní s metenyl-THFA náročnejšia. Redukciu metenyl-THMPT katalyzuje tzv. hydrogenáza bez železosírneho klastru.[3] Tento názov ju odlišuje od takzvaných len Fe hydrogenáz, ktoré obsahujú Fe-S klaster.
Referencie
[upraviť | upraviť zdroj]- ↑ a b Thauer RK. Biochemistry of methanogenesis: a tribute to Marjory Stephenson. 1998 Marjory Stephenson Prize Lecture. Microbiology, September 1998, s. 2377–406. Dostupné online. DOI: 10.1099/00221287-144-9-2377. PMID 9782487. Archivované 2020-05-17 na Wayback Machine
- ↑ The structure of formylmethanofuran: tetrahydromethanopterin formyltransferase in complex with its coenzymes. J. Mol. Biol., March 2006, s. 870–9. DOI: 10.1016/j.jmb.2006.01.015. PMID 16466742.
- ↑ a b The iron-sulfur cluster-free hydrogenase (Hmd) is a metalloenzyme with a novel iron binding motif. J. Biol. Chem., October 2006, s. 30804–13. DOI: 10.1074/jbc.M605306200. PMID 16887798.
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Tetrahydromethanopterin na anglickej Wikipédii.
| Aktívne formy |
| ||||||
|---|---|---|---|---|---|---|---|
| Základné formy | |||||||
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
