Хлороформ
Материал из Википедии — свободной энциклопедии
| Хлороформ | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
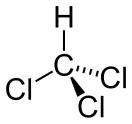
| Хим. формула | CHCl3 | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 119,38 г/моль | ||
| Плотность |
1,524 г/см³ (при 0 °C) |
||
| Энергия ионизации | 11,42 ± 0,01 эВ[2] и 11,37 эВ[3] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −63,5 °C | ||
| • кипения | 61,2 °C | ||
| • разложения | 450 °C | ||
| Энтальпия | |||
| • образования | −131,8 кДж/моль | ||
| Давление пара | 160 ± 1 мм рт.ст.[2] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 15.7 (20 °C) | ||
| Растворимость | |||
| • в воде |
10.62 г/л (0 °C) |
||
| • в ацетоне | ≥ 100 г/л (19 °C) | ||
| • в DMSO | ≥ 100 г/л (19 °C) | ||
| Оптические свойства | |||
| Показатель преломления | 1,4467 | ||
| Структура | |||
| Дипольный момент | 3,5E−30 Кл·м[3] | ||
| Классификация | |||
| Рег. номер CAS | 67-66-3 | ||
| PubChem | 6212 | ||
| Рег. номер EINECS | 200-663-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | FS9100000 | ||
| ChEBI | 35255 | ||
| ChemSpider | 5977 | ||
| Безопасность | |||
| Предельная концентрация | 5 мг/м3[1] | ||
| Токсичность | токсично | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Хлорофо́рм (он же трихлормета́н, метилтрихлори́д, хладо́н 20) — органическое химическое соединение с формулой CHCl3[4]. При нормальных условиях — бесцветная летучая жидкость c эфирным запахом и сладким вкусом. Практически нерастворим в воде — образует с ней растворы с массовой долей до 0,23 %, — смешивается с большинством органических растворителей. Негорюч. Возможны отравления фосгеном при работе с хлороформом, который долго хранился на свету в тёплом месте[5].
История
[править | править код]Хлороформ был впервые получен в 1831 году независимо в качестве растворителя каучука Самуэлем Гатри (Samuel Guthrie), затем Либигом (Justus von Liebig) и Субейраном (Eugène Soubeiran).
Формулу хлороформа установил французский химик Дюма (Dumas). Он же и придумал в 1834 г. название «хлороформ», благодаря свойству этого соединения образовывать муравьиную кислоту при гидролизе (лат. formica переводится как «муравей»).
В клинической практике в качестве общего анестетика хлороформ первым применил Холмс Кут (Holmes Coote) в 1847 г., в широкую практику он был внедрён акушером Джеймсом Симпсоном, который использовал хлороформ для уменьшения боли при родах.
В России метод производства медицинского хлороформа предложил учёный Борис Збарский в 1916 году, когда проживал на Урале в селе Всеволодо-Вильва в Пермском крае.
Физические свойства
[править | править код]- Показатель преломления: 1,44858 при 15 °C.
- Температура кристаллизации: −63,55 °C
- Температура кипения: 61,152 °C
- Дипольный момент: 1,15 дебая
- Диэлектрическая проницаемость: 4,806 при 20 °C
- Образует азеотропную смесь с водой (т. кип. 56,2 °C, 97,4 % хлороформа).
Химические свойства
[править | править код]Образует азеотропную смесь с водой (т. кип. 56,2 °C, 97,4 % хлороформа).
С кислородом воздуха при ненадлежащем хранении (на свету) образует фосген:
Поступающий в продажу хлороформ содержит этиловый спирт (1—2 %) в качестве стабилизатора, который связывает образующийся фосген.
Получение
[править | править код]В промышленности хлороформ производят хлорированием метана или хлорметана. Реакционную смесь нагревают до температуры 400—500 °C. При этом происходит серия химических реакций. Подобное происходит также при освещении смеси ультрафиолетом.
Общая реакция:
Результатом процесса является смесь, состоящая из хлорметана, дихлорметана, хлороформа и тетрахлорметана. Разделение веществ осуществляется ректификацией.
В лаборатории хлороформ можно получить при помощи галоформной реакции[6] или по реакции между ацетоном или этанолом и хлорной известью.
Применение
[править | править код]В конце XIX и начале XX вв. хлороформ использовался как анестетик при проведении хирургических операций. Впервые как средство для наркоза хлороформ был применён при хирургических операциях шотландским врачом сэром Джеймсом Янгом Симпсоном (1848 год). В России хлороформ как средство для наркоза впервые применил Н. И. Пирогов. Однако в данной роли хлороформ впоследствии был заменён более безопасными веществами.
Хлороформ используется для производства хлордифторметана — фреона (хладона-22) путём реакции обмена атомов хлора на фтор при обработке хлороформа безводным фтористым водородом в присутствии хлорида сурьмы(V) (по реакции Свартса)[7]:
Хлороформ также используется в качестве растворителя в фармакологической промышленности, а также для производства красителей и пестицидов. Хлороформ, содержащий дейтерий (CDCl3) — наиболее общий растворитель, используемый в ядерном магнитном резонансе (ЯМР).
Хлороформ применяют в пробе Бейльштейна, в этой реакции наблюдается окрашивание пламени в голубовато-зелёный цвет ионами меди.
Обнаружение хлороформа
[править | править код]В пробирку вносят 1-2 мл исследуемого раствора и 1 мл 10%-го спиртового раствора гидроксида натрия. Пробирку осторожно нагревают на пламени газовой горелки в течение 3-5 мин. После охлаждения раствора его подкисляют 10%-раствором азотной кислоты до кислой реакции на лакмус и прибавляют 0,5 мл 1%-го раствора нитрата серебра. Появление белого растворимого в аммиаке осадка указывает на наличие хлороформа в исследуемом растворе. Эта реакция не специфична. Её дают и другие хлорорганические соединения (хлоральгидрат, четырёххлористый углерод, дихлорэтан и др.)
Очистка
[править | править код]Процесс очистки делится на ряд этапов. Сперва хлороформ встряхивают с концентрированной серной кислотой, промывают водой, сушат над хлоридом кальция либо сульфатом магния и перегоняют. Проверить на чистоту хлороформ можно испарением с фильтровальной бумаги: после хлороформа не должно оставаться запаха. Затхлый, резкий, раздражающий запах говорит о наличии примесей хлора, хлороводорода или фосгена.
Воздействие на организм
[править | править код]Вдыхание хлороформа пагубно влияет на работу центральной нервной системы. Вдыхание воздуха с содержанием хлороформа порядка 0,09 % (900 ppm) за короткое время может вызвать головокружение, усталость и головную боль. Постоянное воздействие хлороформа может вызвать заболевания печени и почек. Приблизительно 10 % населения Земли имеют аллергическую реакцию на хлороформ, приводящую к повышению температуры тела (до 40 °C). Часто вызывает рвоту (частота послеоперационной рвоты достигала 75—80 %).
Исследования на животных показали, что у беременных крыс и мышей, которые дышали воздухом с содержанием хлороформа 0,003 % (30 ppm), происходили выкидыши. Также такое наблюдалось у крыс, которым давали хлороформ перорально. Следующие поколения крыс и мышей, которые вдыхали хлороформ, имели больший процент врождённых дефектов по сравнению с неподвергавшимися воздействию.
Влияние хлороформа на размножение у людей недостаточно хорошо изучено. При длительном воздействии на дыхательные пути и слизистые оболочки человека (2—10 минут) возможен летальный исход. Предположительно мутагенен и канцерогенен. Данные свойства проявляются только при превышении концентрации хлороформа в воздухе.
При попадании в организм хлороформ довольно быстро выводится с выдыхаемым воздухом: через 15—20 мин. — 30—50 % хлороформа, в течение часа — до 90 %. Остаток хлороформа в организме в результате биотрансформации превращается в диоксид углерода и хлороводород[8].
Однако это не единственный процесс метаболизма хлороформа в организме. Показано, что в организме млекопитающих хлороформ метаболизируется в фосген, с участием микросомальных ферментов из группы монооксигеназ цитохрома p450, через промежуточную стадию образования трихлорметанола и трихлорметилпероксила.[9] Показано также, что применение ингибиторов работы цитохрома р450 уменьшает токсический эффект хлороформа, йодоформа и тетрахлорида углерода (все они метаболизируются по одному пути, через схожие радикалы).[10]
По российскому гигиеническому нормативу, среднесменная ПДК 5 мг/м3, максимально разовая — 10 мг/м3[1]. В то же время порог восприятия запаха хлороформа может составлять, например, 650 мг/м3[11]; и даже 1350 мг/м3[12].
Примечания
[править | править код]- ↑ 1 2 (Роспотребнадзор). № 2098. Трихлорметан (Хлороформ) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой. — Москва, 2018. — С. 143. — 170 с. — (Санитарные правила). Архивировано 12 июня 2020 года.
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0127.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Аляутдин P. Н.; Маневич A. 3. (анест.), Хесин Я. E. (гист.). Хлороформ // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1986. — Т. 27 : Хлоракон — Экономика здравоохранения. — С. 16—17. — 576 с. : ил.
- ↑ Хлороформ ⌬ органические растворители на Chemical Region. Дата обращения: 11 мая 2009. Архивировано из оригинала 27 октября 2009 года.
- ↑ Chakrabartty, in Trahanovsky, Oxidation in Organic Chemistry, pp 343—370, Academic Press, New York, 1978
- ↑ Промышленные фторорганические продукты: справочное издание / Б.Н. Максимов, В.Г. Барабанов, И.Л. Серушкин и др.. — 2-е, перераб. и доп.. — СПб.: «Химия», 1996. — 544 с. — ISBN 5-7245-1043-X.
- ↑ В. Ф. Крамаренко. Токсикологическая химия. — К.: Выща шк., 1989. — 447 с. — 6000 экз. — ISBN 5-11-000148-0.
- ↑ Pohl L. R. et al. Phosgene: a metabolite of chloroform //Biochemical and biophysical research communications. — 1977. — Т. 79. — №. 3. — С. 684—691.
- ↑ Weber L. W. D., Boll M., Stampfl A. Hepatotoxicity and mechanism of action of haloalkanes: carbon tetrachloride as a toxicological model //Critical reviews in toxicology. — 2003. — Т. 33. — №. 2. — С. 105—136.
- ↑ Pieter H. Punter. Measurement of human olfactory thresholds for several groups of structurally related compounds (англ.) // Chemical Senses. — Oxford University Press, 1983. — July (vol. 7 (iss. 3—4). — P. 215–235. — ISSN 1464-3553. — doi:10.1093/chemse/7.3-4.215. Архивировано 16 ноября 2019 года.
- ↑ Andrew Dravnieks. A building-block model for the characterization of odorant molecules and their odors (англ.) // The New York Academy of Sciences Annals of the New York Academy of Sciences. — New York: John Wiley & Sons, 1974. — September (vol. 237 (iss. 0). — P. 144—163. — ISSN 1749-6632. — doi:10.1111/j.1749-6632.1974.tb49851.x. — PMID 4529228. Архивировано 5 ноября 2019 года.
| Алканы и циклоалканы | |
|---|---|
| Алкены и алкины | |
| Спирты, кетоны, альдегиды | |
| Кислоты и ангидриды | |
| Ароматические соединения | |
| Элементоорганические соединения (N,P,As,S) | |
| Высокомолекулярные соединения | |
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.