Хлорангидриды карбоновых кислот
Материал из Википедии — свободной энциклопедии
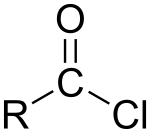
Хлорангидри́д карбо́новой кислоты́ (ацилхлорид) — производное карбоновой кислоты, в которой гидроксильная группа -OH в карбоксильной группе -COOH заменена на атом хлора. Общая формула R-COCl. Первый представитель с R=H (хлористый формил) не существует, хотя смесь CO и HCl в реакции Гаттермана — Коха ведёт себя подобно хлорангидриду муравьиной кислоты.
Номенклатура
[править | править код]Названия хлорангидридов производятся от названий соответствующих кислотных остатков (ацилов) путём добавления к ним слова хлористый в начале или слова хлорид в конце.
Физические свойства
[править | править код]Хлорангидриды по большей части жидкости, кипят при значительно более низких температурах чем соответствующая кислота из-за отсутствия межмолекулярных водородных связей. Например, уксусная кислота кипит при 118 °C, в то время как ацетилхлорид при 51 °C. В ИК-спектрах хлорангидридов содержится, как и у других карбонильных соединений, интенсивная полоса поглощения при 1800 см−1.
Получение
[править | править код]Получают хлорангидриды чаще всего взаимодействием безводной карбоновой кислоты с тионилхлоридом (SOCl2)[1], трёххлористым фосфором (PCl3)[2] или пятихлористым фосфором (PCl5)[3], фосгеном (COCl2)[4].
Ещё один метод мягкого получения хлорангидридов основан на использовании оксалилхлорида
Есть методы получения хлорангидридов без выделения хлороводорода, например, реакция Аппеля.
или используя цианурхлорид[5]
В реакции с тионилхлоридом образуются газообразная двуокись серы и хлороводород, которые легко удаляются из реакционного сосуда, способствуя прохождению реакции. Избыток тионилхлорида (т.кип. 79 °C) легко удаляется на роторном испарителе. Механизм реакции для тионилхлорида и пятихлористого фосфора похожи.
Реакция с оксалилхлоридом катализируется диметилформамидом. На первой стадии образуется иминевый интермедиат
Иминиевая соль реагирует с кислотой, отбирая кислород и регенирируя диметилформамид.
Реакции
[править | править код]Хлорангидриды химически исключительно активны.
Нуклеофильные
[править | править код]Наличие кислорода и хлора, сильных электроноакцепторов, при одном атоме углерода создаёт большой положительный заряд на данном атоме, превращая его таким образом в цель нуклеофильных атак даже для слабых нуклеофилов. Атом хлора является хорошей уходящей группой, что способствует нуклеофильному замещению.
С водой низшие хлорангидриды реагируют чрезвычайно энергично, образуя соответствующую карбоновую кислоту и соляную кислоту:
Менее энергично происходит взаимодействие со спиртами
Аналогично реагируют тиолы
Реакция с аммиаком, первичными и вторичными аминами приводит к соответствующим амидам:
Реакцией с солями карбоновых кислот получают ангидриды карбоновых кислот
Также они реагируют с цианидами
Применение раствора щёлочи, пиридина или избытка амина в данных реакциях желательно для удаления побочного продукта — хлороводорода и катализа реакции. Реакция карбоновых кислот со спиртами и аминами обратима, что приводит к невысоким выходам. В то же время реакция с хлорангидридами быстра и необратима, а их синтез довольно прост, что делает двухстадийный процесс предпочтительнее.
С углеродными нуклеофилами
[править | править код]С углеродными нуклеофилами такими как реактивы Гриньяра ацилхлориды реагируют быстро с образованием кетонов. Использование избытка реактива Гриньяра приводит к получению третичных спиртов. В то же время реакция с кадмийорганическими соединениями останавливается на стадии образования кетона. Аналогичным образом проходят реакции с реактивами Гилмана (например, литий диметилмедью (CH3)2CuLi). В целом ароматические ангидриды менее реакционноспособны и требуют более жестких условий проведения реакции чем алкильные.
Восстановление нуклеофилами
[править | править код]Хлорангидриды восстанавливаются такими сильными восстановителями как LiAlH4 или ДИБАЛ-Н с образованием первичных спиртов.
Литий тритретбутоксиалюминий гидрид (LiAlH(Ot-Bu)3), объёмистый восстановитель, восстанавливает до альдегидов также как и в реакции Розенмунда — Зайцева водородом над «отравленном» паладиевым катализатором.
Электрофильные
[править | править код]Хлорангидриды карбоновых кислот в присутствии кислот Льюиса (хлорид железа(III), хлорид алюминия) вступают в реакцию Фриделя-Крафтса с ароматическими соединениями, образуя ароматические кетоны.
Первая стадия — отщепление атома хлора кислотой Льюса
далее следует атака ароматического соединения карбкатионом
затем происходит отщепление водорода с образованием хлороводорода, освобождающийся хлорид алюминия образовывает комплекс с ароматическим кетоном по атому кислорода
Применение
[править | править код]Благодаря высокой реакционной способности хлорангидриды широко применяются в органическом синтезе в качестве ацилирующего агента для введения в синтезируемую молекулу остатка карбоновой кислоты (ацильная группа).
Безопасность
[править | править код]Из-за высокой активности ацилхлориды обладают общей токсичностью, работа с ними должна вестись с должной осторожностью (защитная одежда, вытяжная вентиляция). Ацилхлориды проявляют лакриматорные свойства из-за гидролиза до хлороводорода и карбоновой кислоты на слизистых оболочках глаз и дыхательных путей.
Ссылки
[править | править код]- ↑ Титце, Айхер Препаративная органическая химия М.:1999, стр. 128
- ↑ Титце, Айхер Препаративная органическая химия М.:1999, стр. 481
- ↑ Титце, Айхер Препаративная органическая химия М.:1999, стр. 159
- ↑ Ulrich, H.; Richter, R. 4-Isocyanatophthalic Anhydride. A Novel Difunctional Monomer, Journal of Organic Chemistry 1973, 38, 2557
- ↑ K. Venkataraman, and D. R. Wagle (1979). «Cyanuric chloride : a useful reagent for converting carboxylic acids into chlorides, esters, amides and peptides». Tetrahedron Letters 20 (32): 3037-3040
См. также
[править | править код]| Алканы и циклоалканы | |
|---|---|
| Алкены и алкины | |
| Спирты, кетоны, альдегиды | |
| Кислоты и ангидриды | |
| Ароматические соединения | |
| Элементоорганические соединения (N,P,As,S) | |
| Высокомолекулярные соединения | |
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.





















