Участник:Kurgus/Draft
Материал из Википедии — свободной энциклопедии
Биолюминесценция -
Таксономическое распределение
[править | править код]См. также Pyrosoma atlanticum и Selected Least Studied but not Forgotten Bioluminescent Systems - http://onlinelibrary.wiley.com/doi/10.1111/php.12704/full
- Phyla with bioluminescent terrestrial members
- Bacteria
- Genus: Photorhabdus - Photorhabdus luminescens Michael B. Blackburn*, John M. Domek, Dale B. Gelman and Jing S. Hu. The broadly insecticidal Photorhabdus luminescens toxin complex a (Tca): Activity against the Colorado potato beetle, Leptinotarsa decemlineata, and sweet potato whitefly, Bemisia tabaci. Journal of Insect Science, 2005. 5:32, en:Photorhabdus luminescens
- Fungi
- Mollusks
- Annelids
- Членистоногие (Arthropoda)
- Насекомые (Insecta)
- Coleoptera
- Diptera
- Многоножки (Myriapoda)
- Chilopoda (Губоногие) [1]
- Diplopoda (Двупарноногие), в частности Luminodesmus sequoiae (500 нм)[2] (и Motyxia sequoia - тот же вид или?...)
- Насекомые (Insecta)
- Bacteria
- Phyla with bioluminescent marine and freshwater members
- Bacteria
- Dinoflagellates (See Figure 8)
- Radiolarians
- Sponges
- Coelenterates
- Ctenophores
- Nermerteans
- Mollusks
- Annelieds
- Arthropods
- Crustacea (у некоторых наблюдалась биолюминесценция вследствие инфекции билоюминесцирующими бактериями)[3]
- Ostracoda
- Copepoda
- Amphipoda
- Mysidacaea
- Euphausiacea
- Decapoda[4]
- Выброс люминесцирующего секрета:
- Oplophoridae, Pandalidae and Thalassocarididae of the Caridea, and in the Penaeidae of the Penaeidea
- Люминесцирующие органы:
- Oplophoridae from the photophores of species of Systellaspis and Oplophorus and from the liver of Hymenodora. The hepatic organs of Parapandalus of the Pandalidae have been seen to luminesce, and among the Penaeidea both the hepatic organs of Pesta of Sergestes and the superficial organs of Sergia
- Выброс люминесцирующего секрета:
- Crustacea (у некоторых наблюдалась биолюминесценция вследствие инфекции билоюминесцирующими бактериями)[3]
- Bryozoa
- Chaetognaths
- Echinoderms
- Hemichordaes
- Chordates
- Vertebrates
- Миктофовые - строение фотофор
История исследований
[править | править код]Известна давно - Плиний (C. Plinivs Secvndvs. Natvralis Historia, Liber IX, XLIII de hirundine. de pisce qui noctibus lucet. de cornuta. de dracone marino /Volat sane perquam similis volucri hirundo, item miluus, subit in summa maria piscis ex argumento appellatus lucerna, linguaque ignea per os exerta tranquillis noctibus relucet./) [1]
В 1668 г. Роберт Бойль, крупнейший представитель пневмохимии, изучавший процессы горения, отметил сходство между процессами горения угля и свечением гнилушек: Бойль, используя остроенный им вакуум-насос, продемонстрировал, что в обоих случаях свечение исчезает, если удалить воздух (т.е. кислород). Сходство с холодным свечением белого фосфора, открытого Брандом в ... г /- кем отмечалось?/.
Пионером в исследовании механизмов биолюминесценции стал Рафаэль Дюбуа, в 1887 г. , поставивший эксперимент с экстрактами из светящихся двустворчатых моллюсков Pholas dactylus: он обнаружил, что экстракт тканей моллюска, полученный гомогенизацией в холодной воде, светится в течение нескольких минут, однако экстракт, приготовленный в горячей воде, не светится. Вместе с тем Дюбуа обнаружил, что если добавить к потухшему холодному экстракту порцию несветящегося горячего экстракта, то свечение возобновляется. Таким образом, за свечение были ответственны две фракции: устойчивая к нагреву низкомолекулярная, и белковая, теряющая активность при нагревании; свечение in vitro возникало только в присутствии обеих фракций и в присутствии кислорода. Аналогичные результаты Дюбуа получил и при эксперименте со светящимися жуками Pyrophorus. Такое поведение типично для систем фермент - субстрат, поэтому Дюбуа назвал низкомолекулярную фракцию люциферином, а белковую - люциферазой и постулировал ферментативную природу реакций, вызывающих биолюминесценцию.
Структура люциферина - идентификация - дата
Работы Дюбуа положили основу для дальнейших работ в исследовании билоюминесценции, оказалось, что у различных групп организмов существует множество систем люциферин - люцифераза.
Эдмунд Ньютон Харви (Edmund Newton Harvey) в Принстонском университете начал работы по изучению биолюминесценции ракообразных в 19... выделил люциферины и люциферазы различных видов, и показал высокую специфичность субстрат-фермент ...

В конце 1950-х - начале 1960-х Осаму Симомура в университете Нагоя исследовал механизм свечения креветок Cypridina hilgendorfii, которые использовались во время Второй Мировой Войны японцами как природный люминофор: высушенные креветки при смачиваении снова начинали светиться. Ему удалось выделить из них в чистом кристаллическом состоянии новый люциферин, отличающийся от люциферина светляков[5]. В качестве объекта дальнейших исследований биолюминесценции в Принстоне он избрал медузу Aequorea victoria, фотофоры которой излучают зелёный свет. Симомура выделил из медуз экворин - белок, содержащий имидазопиразин целентеразин и показал, что биолюминесценция экворина инициируется ионами кальция, при этом, в отличие от классической биолюминесценции, для излучения света экворином кислород не требовался. Это стало открытием нового класса биолюминесцентных систем - фотопротеинов, в которых светоизлучающий фрагмент является не субстратом - люциферином, а простетической группой, прочно связанной с белком.
Симомура также обнаружил, что выделенный из медузы и очищенный экворин in vitro излучает синий свет, в то время как живая медуза светится зелёным. Дальнейшие исследования показали, что за зелёное свечение ответственен другой белок - GFP (англ. green fluorescent protein - зелёный флуоресцентный белок), флуоресцирующий зелёным светом под действием голубого излучния экворина; и экворин, и GFP в дальнейшем вошли в лабораторную практику молекулярной биологии, первый - как индикатор присутствия ионов Ca2+, второй - в качестве флуоресцентной метки для изучения экспрессии клеточных белков. За работы по GFP Симомура был удостоен нобелевской премии по химии 2008 года.
Физико-химические механизмы биолюминесценции
[править | править код]Хемилюминесценция возникает при многих химических реакциях - например, при рекомбинации свободных радикалов или в реакциях окисления (при свободнорадикальном окислении паров белого фосфора в газовой фазе, окислении люминола в водном растворе и т.п.). В этом случае, как и в реакциях биолюминесценции, выделяющаяся энергия не рассеивается в виде тепла, как это происходит в ходе большинства экзотермических химических реакций, а расходуется на образование одного из продуктов реакции в возбуждённом электронном состоянии. Для излучения света в ходе хемилюминесцентной реакции необходимо выполнение, как минимум, двух условий: во-первых, энергия, выделяющаяся в ходе реакции должна превышать ~41-71.5 ккал/моль (что соответствует энергиям электромагнитного излучения в видимом диапазоне ~400-700 нм и значительно превышает энергию гидролиза АТФ до АМФ - 10.9 ккал/моль) и, во-вторых, разница энергий основного и воздуждённого состояния продукта реакции должна быть ниже энтальпии химической реакции.
При соблюдении этих условий возможно образование с достаточно высоким выходом окисленной формы люциферина в возбуждённом состоянии и дальнейший переход в основное состояние с испусканием фотона видимого спектрального диапазона. Отношение числа излученных фотонов к общему числу элементарных актов реакиии называется квантовым выходом реакции, квантовые выходы биолюсминесценции, в отличие от большинства хемилюминесцентных реакций, очень высоки и достигают значений 0.1-1. Такие квантовые выходы для реакций, протекающих в водных растворах при нейтральных значениях pH необычны для хемилюминесцентных процессов и обусловлены специфичным ферментативной природой окислительных реакций биолюминесценции, каталзируемых люциферазными комплексами.
Длина волны излучаемого при биолюминесцентных процессах света зависит от разности энергий основного и возбуждённого состояний окислённых форм люциферинов и связанна с ней отношением , полуширина полосы излучения составляет обычно ~50 нм. Поскольку процесс перехода возбуждённое - основное состояние обратим, то спектры флуоресценции оксилюциферинов близки к спектрам биолюминесценции: в обоих случаях излучает молекула оксилюциферина, переведённая в возбуждённое состояние либо вследствие химической реакции (биолюминесценция), либо вследствие поглощения достаточно энергетичного фотона.

A - нейтральная кетоформа λmax = 618 нм
B - анион (фенолят) кетоформы
C - анион енольной формы, λmax = 587 нм
D - енолят-дианион, λmax = 556 нм
Вместе с тем, максимум в спектре излучения в биолюминесцентных процессах может изменяться в зависимости от условий протекания реакции. Например, несмотря на то, что химизм биолюминесценции жуков-светляков одинаков и структуры люциферина и оксилюциферина различных видов идентичны, цвет свечения может варьировать от зелёного до красного, т.е. максимум в спектре излучения может меняться от 490 до 622 нм. Более того, у личинок бразильских жуков-фенгонид рода Phrixothrix есть несколько органов-фотофоров, испускающих свет различных оттенков - красного фотофоров головы и желто-зеленого фотофоров брюшка[6]. Такое изменение спектра излучения возможно, когда оксилюциферин может существовать в нескольких формах с различной энергией основного состояния, что, в свою очередь, соответствует различающимся энергиям перехода из возбуждённого состояния и, вследствие этого, к различным максимумам в спектре излучения при переходе из возбуждённого состояния в основное.
Оксилюциферин светляков способен к кето-енольной таутомерии и в растворах существует в виде смеси кетонной и енольной форм. Отношение количеств кето- и енольного таутомеров зависит от pH среды: в слабощелочных условиях (pH 7.5 - 7.8 и выше) преобладает енольная форма, при этом максимум в спектре биолюминесценции приходится на 587 нм, т.е. на желто-зелёную область, при закислении среды (pH < 6) преобладающей становится кетонная форма и максимум в спектре излучения сдвигается в длинноволновую область до 618 нм, т.е. в красную область. При подщелачивании среды образуется енолят-анион оксилюциферина, и максимум в спектре смещается в коротковолновую область до 556 нм. При промежуточных значениях pH в растворе присутствует смесь обеих форм и спектр излучения оказывается бимодальным, воспринимаемый глазом промежуточный оттенок получается вследствие аддитивного смещения желто-зелёного и красного света[7].
Другим фактором, влияющим на спектр биолюминесценции, является микроокружение молекулы оксилюциферина в основном и возбуждённом состояниях. На значения энергетических уровней основного и возбуждённого состояний молекулы оксилюциферина в среде оказывает влияние и энергия их взаимодействия как с люциферазой[8], так и с растворителем (энергия сольватации), и образование водородных связей: чем сильнее возбуждённая молекула ассоциирована с микроокружением и чем выше его поляризуемость, тем ниже энергия возбуждённого состояния, тем меньше энергия испускаемого фотона и тем сильнее сдвиг максимума спектра излучения в длинноволновую область.

A - возбуждённая молекула оксилюциферина в микроокружении молекулы - предшественницы
R - релаксация сольватной оболочки и белкового окружения
B - возбуждённая молекула оксилюциферина в релаксировавшем микроокружении
P - протонирование или таутомеризация
C - таутомер оксилюциферина
Энергии S1 > S1R > S1P, максимумы излучения λAmax < λBmax < λCmax
Третьим фактором, влияющим на энергию возбуждённого состояния оксилюциферина и, соответственно, спектральный максимум, являются релаксационные процессы микроокружения. При отщеплении CO2 от 1,2-диоксетанового предшественника оксилюциферина светляков происходит очень быстрая перестройка электронной структуры молекулы и резкое изменение её дипольного момента, при этом возбуждённая молекула оказывается в сольватной оболочке молекулы - предшественницы. Время жизни молекулы осилюциферина в возбуждённом синглетном состоянии составляет ~ 10-9-10-8 секунды, и если за это время молекулы растворителя или окружающие активный центр белковые цепи люциферазы не успевают переориентироваться в новое равновесное состояние, то энергия возбуждённого состояния оксилюциферина оказывается максимальной, а максимум спектра сдвинут в коротковолновую область, то есть длина волны излучаемого света оказыватся зависимой от скорости релаксации микроокружения - и в том числе от подвижности белковых цепей люциферазы[9]
И, наконец, особым случаем, ведущим к изменению спектра биолюминесценции, является переизлучение энергии, выделяемой при окислении люциферинов, флуоресцентными белками - такой механизм наблюдается у некоторых люминесцирующх бактерий и медуз и приводит к смещению спектрального максимума в длинноволновую область. У бактерий, в клетках которых присутствует желтый флуоресцентный белок (YFP, англ. yellow fluorescent protein) предполагается индуктивно-резонансный межмолекулярный перенос энергии (механизм Фёрстера) от люциферин-люциферазного комплекса к флуоресцентному белку. Этот механизм может играть весьма существенную роль и становиться основым механизмом биолюминесценции: было показано, что in vitro при добавлении к целентеразиновой люциферин-люциферазной системе полипов-альционарий Renilla reniformis, излучающей с максимумом 480 нм, зелёного флуоресцентного белка Renilla квантовый выход люминесценции на длине волны GFP 510 нм повышается в три раза [10].
Типы люциферин-люциферазных систем
[править | править код]Как уже упоминалось, необходимым условием биолюминесценции является высокая энтальпия реакции окисления люциферина: энергия, выделяющаяся в ходе реакции должна превышать ~41-71.5 ккал/моль, — что соответствует энергиям электромагнитного излучения в видимом диапазоне ~400-700 нм, эта энергия соизмерима с энергией связи C-C в алканах (~79 ккал/моль). Такой энергетический эффект значительно превышает энергетические эффекты большинства биохимических реакций — в том числе и с участием макроэргических соединений — носителей энергии в живых системах; так, например, энергия, высвобождающаяся при гидролизе АТФ до АМФ составляет 10.9 ккал/моль.
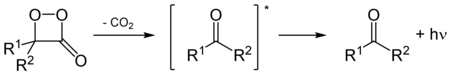
Энергия, соответствующая энергиям видимого спектра, в живых системах может быть получена только в реакциях одностадийного окисления с участием молекулярного кислорода (или активных форм кислорода), поэтому большинство люцифераз относятся к классу ферментов — оксигеназ, катализирующих реакции, в которых происходит присоединение кислорода к субстрату-люциферину (за немногими исключениями люцифераз кольчатых червей, обладающих пероксидазоподобной активностью) и, соответственно, все светящиеся организмы являются аэробами.
Многие люциферины при окислении образуют циклические напряжённые промежуточные пероксиды — диоксетаноны, в которых валентные углы в четырёхчленном цикле существенно отличаются от нормальных валентных углов, такие соединения далее распадаются с выделением молекулы углекислого газа и образованием возбуждённого кетона-люциферина. Такой механизм реакции характерен для окисления люциферина насекомых и целентеразинов — люциферинов многих морских организмов.
В настоящее время известно шесть основных классов люциферинов различной химической природы, распространенные в различных группах живых организмов: альдегид-флавиновая система бактерий и некоторых грибов, альдегидные люциферины морских червей и пресноводных моллюсков, тетрапирролы динофлагеллят и некоторых ракообразных, имидазопиразолы различных морских организмов и люциферин насекомых — производное тиазола и пираноновая система грибов[11].
Альдегид-флавиновая система бактерий
[править | править код]Биолюминесцирующие бактерии широко распространены в морских экосистемах, и среди них присутствуют как свободноживущие в морской воде виды, так и фотобактерии-симбионты, обитающие в фотофорах светящихся организмов (рыб, головоногих) и обуславливающих их свечение. Эти фотобактерии принадлежат родам Alteromonas (Shewanella), Beneckea, Photobacterium и Vibrio, причем представители рода Photobacterium преимущественно являются симбионтами, обитающими в светящихся органах морских организмов - головоногих и рыб. На суше фотобактериями представлены родами Vibrio и Xenorhabdus (Xenorhabdus Luminescens являются симбионтами нематод-паразитов гусениц)[12].
До середины XX века механизм бактериальной биолюминесценции оставался неизвестным - трудность заключалась в том, что провести классическую люциферин-люциферазную реакцию с экстрактами бактерий по Дюбуа не удавалось. В 1953 г. Стрелер обнаружил, что восстановленная форма никотинамидадениндинуклеотида (NADH) вызывает свечение бактериального экстракта - однако это свечение имеет весьма невысокую интенсивность, которая, однако, существенно возрастает при добавлении прокипяченного бактериального экстракта. Предположив, что носителем активирующего фактора являются фрагменты бактериальных клеток, присутствующие в экстракте, Стрелер совместно с Милтоном Кормье предприняли систематическое тестирование экстрактов различных тканей животных на стимулирующую свечение активность. В итоге, они обнаружили, что экстракты печени и коркового вещества почек свиньи активируют люминесценцию бактериального экстракта в присутствии NADH и кислорода, экстракцией хлороформом коркового вещества почек свиньи и дальнейшей очисткой экстракта им удалось выделить активирующий люминесценцию фактор в чистом виде - им оказался алифатический альдегид гексадеканаль. Стрелер и Кормье также обнаружили что и альдегиды-гомологи, в частности деканаль и додеканаль, также активируют люминесценцию[13],[14]. В течение 20 лет роль альдегида и природа соединения-эмиттера, ответственного за излучение света, оставались неизвестными.
Дальнейшим шагом стали работы Мак Элроя и Грина (1955 г.), продемонстрировавших, что для реакции люминесценции, катализируемой бактериальным люциферазным комплексом, кроме NADH, алифатического альдегида и кислорода, необходимо и производное рибофлавина - флавинмононуклеотид, являющийся коферментом многих оксидоредуктаз и встречающийся во всех живых организмах. Сопряженное окисление восстановленого флавинмононуклеотида и альдегида приводит к образованию возбужденного флавинового фрагмента, испускающего голубой свет с λmax 490 нм:
- RCHO + FMNH2 + O2 = RCOOH + FMN + H2O + hν ,
процесс катализируется бактериальной люциферазой - ФМН-зависимая алканальмонооксигеназа (англ. alkanal monooxygenase (FMN-linked), КФ 1.14.14.3):
Механизм биолюминесценции бактерий:
1. К молекуле FMNH2 присоединяется молекула кислорода с образованием гидропероксида A
2. Гидропероксид A реагирует с альдегидом, образуя пероксиполуацеталь B
3. Пероксиполуацеталь B претерпевает перегруппировку Байера-Вилигера с образованием карбоновой кислоты и эмиттера C - 4а-гидрокси-5-гидрофлавинмононуклеотида в возбужденном состоянии
4. Эмиттер C испускает квант света и отщепляет молекулу воды, образуя флавинмононуклеотид
5. Флавинмононуклеотид FMN восстанавливается NADH до исходного FMN при катализе NAD(F) H: FMN-оксидоредуктазой
Таким образом, люминесцентный комплекс бактерий, в отличие от люциферин-люциферазных систем большинства многоклеточных организмов, обладает рядом замечательных особенностей. Во-первых, поскольку при окислении расходуется альдегид, то, формально, он является люциферином - но, в отличие от люциферинов динофлагеллят, кишечнополостных и членистоногих, не является эмиттером света. Во-вторых, в качестве двух ключевых компонентов люминесцентной цепи выступают NAD и FMN - нуклеотиды-коферменты оксидоредуктаз, встречающиеся во всех организмах, производное последнего является эмиттером. В третьих, в клетках многих светящихся бактерий присутствуют флуоресцентные белки, переизлучающие испускаемый возбужденным 4а-гидроксифлавин-люциферазным комплексом сине-зеленый свет в длинноволновой желто-зеленой области.
В настоящее время известно два типа таких флуоресцентных белков - «люмазиновые белки» (LumP), содержащие в качестве флуорофора производное 2,4-диоксоптеридина (люмазина) - 6,7-диметил-8-(1’-D- рибитил)люмазин, присутствующие в бактериях P. Phosphoreum и P. Fisheri, и желтый флуоресцентный белок (англ. yellow fluorescent protein, YFP) штамма Y-1 бактерии P. Fisheri, содержащий в качестве флуорофора флавинмононуклеотид или рибофлавин. В присутствии LumP максимум излучения сдвигается до 475 нм, в присутствии YFP - до 540 нм.
Структура бактериальной люцифразы сходна со структурой нефлуоресцирующего бактериального флавопротеида - предполагается, что оба этих белка в ходе эволюции произошли от одного предшественника. По данным рентгеноструктурного анализа люцифераза является гетеродимером, состоящим из двух субъединиц, причем предполагается, что FMH в бактериальной люциферазе играет роль не кофактора, а субстрата [15].
ФРАГМЕНТ ВЫШЕ перенесен в статью 21.08.2020 НЕ ИСПОЛЬЗОВАНО на 21.08.2020:
Регенерация субстрата - EC 6.2.1.19 together with EC 1.2.1.50 long-chain-fatty-acyl-CoA reductase, enzyme forms a fatty acid reductase system that produces the substrate of EC 1.14.14.3 alkanal monooxygenase (FMN-linked), thus being a component of the bacterial luciferase system
КФ 6.2.1.19 лигаза длинноцепочечных жирных кислот — люциферина (англ. long-chain-fatty-acid—luciferin-component ligase)
- ATP + RCOOH + protein = AMP + diphosphate + RCOS-protein
КФ 1.2.1.50 ацил-КоА редуктаза длинноцепочечных жирных кислот (англ. long-chain-fatty-acyl-CoA reductase)
- RCHO + CoA + NADP+ = RCO-CoA + NADPH + H+
И, наконец, особенностью биолюминесценции бактерий является
/У многих морских видов/ Бактерии могут быть симбионтами, живущими в фотофорах некоторых видов кальмаров кальмаров и рыб,
Флавиновая система грибов Lampteromyces
[править | править код]Другим примером биолюминесции, в которой эмиттером является рибофлавин, является люминесценция японских грибов Lampteromyces japonicus. Детально механизмы биолюминесценции этих грибов пока неизвестны - в настоящее время надежно не идентифицированы ни люциферин, ни люцифераза, однако было показано, что свет испускается ламптерофлавином - рабофлавинил-α-рибофуранозидом и in vitro люминесценция гомогената, содержащего ламптерофлавин, индуцируется добавлением L-тирозина[16].
ФРАГМЕНТ ПЕРЕНЕСЕН в осн. стать. 20.08.2020 Ламптерофлавин - http://www.chemspider.com/Chemical-Structure.10320854.html
Пироновая система грибов
[править | править код]Бимолюминесценция - зеленое свеченик с максимумом в 520-530 нм - характерна для многих родов высших грибов (Mycena, Omphalotus, Armillarea и др.) и изучается уже более 100 лет, однако ее механизмы - в том числе попытки выделить и идентифицировать люциферин - долгое время оставались безуспешными. В качестве кандидатов на роль предшественников люциферинов грибов предлягался ряд алициклических и ароматических альдегидов - в т.ч. альдегид кофейной кислоты[17].
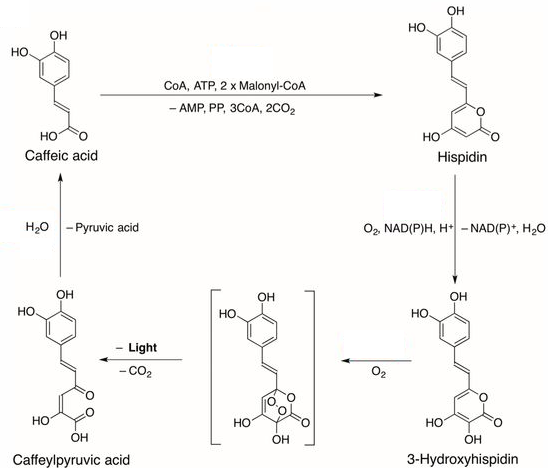
По крайней мере один из люциферинов грибов был идентифицирован в начале XXI века - им оказался 3-гидроксигиспидин, производное α-пирона, предшественником которого, хотя и не непосредственным, является кофейная кислота[18].
При биосинтезе 3-гидроксигиспидина кофейная кислота конденсируется с малонил-коферментом-А (Malonyl-CoA), образуя широко распространенный в составе грибов гиспидин. В свою очередь, гиспидин окисляется при катализе NAD-гидроксилазой с образованием люциферина - 3-гидроксигиспидина.
Присоединение к α-пироновому фрагменту 3-гидроксигиспидина кислорода, катализируемое люциферазой гриба, приводит к образованию мостикового пероксида, который разлагается, испуская свет, с образованием кафеилпировиноградной кислоты, последняя гидролизуется с образованием исходной кофейной кислоты[19]:
ПЕРЕНЕСЕНО в осн. ст. 20.08.2020 USED Обзор Симомуры Vladimir S. Bondar, Osamu Shimomura and Josef I. Gitelson. Luminescence of Higher Mushrooms. Journal of Siberian Federal University. Biology 4 (2012 5) 331-351 Fig.6 - предшественники люциферинов, в т.ч. альдегид кофейной кислоты у Mycena citricolor
USED Zinaida M. Kaskova et al. Mechanism and color modulation of fungal bioluminescence. Science Advances Apr 2017: Vol. 3, no. 4, e1602847, DOI: 10.1126/sciadv.1602847 - люциферин - 3-hydroxyhispidin (см. en:Hispidin), содержащий структурный фрагмент кофейной кислоты.
Alexey A. Kotlobay et al. Genetically encodable bioluminescent system from fungi. PNAS December 11, 2018 115 (50) 12728-12732; 2018 https://doi.org/10.1073/pnas.1803615115 - биосинтез: кофейная кислота + Малонил-CoA - гиспидин; гиспидин + O2 NADP-H - 3-hydroxyhispidin
Также http://www.sydneyfungalstudies.org.au/articles/Bioluminescent%20Fungi%20-%20Magic%20and%20Mechanism.pdf
ИБОХ Царькова http://www.ibch.ru/en/structure/groups/TotalSynthesis/957
Тетрапирролы динофлагеллят и ракообразных
[править | править код]Еще одним примером люциферин-люциферазных систем, в которых участвуют люциферины, структурно близкие с веществами, вовлеченными в основные метаболические процессы, являются тетрапиррольные люциферины одноклеточных водорослей - динофлагеллят и эвфаузиевых ракообразных (к которым относится и криль). Окисление этих люциферинов ведет к голубому свечению, свечение динофлагеллят при их массовом размножении обуславливает свечение моря.
Структура этих люциферинов (A) содержит четыре пиррольных ядра и очень близка к структуре хлорофилла C1 (B), однако, в отличие от хлорофиллов тетрапиррольные люциферины незамкнуты; люциферин эфваузид представляет собой гидроксипроизводное люциферина динофлагеллят[11].
В настоящее время окончательно не выяснено, синтезируют ли эфваузиды люциферин самостоятельно или получают его при питании динофлагеллятами.
Перенесено в осн. ст. 20.02 ФРАГМЕНТ НИЖЕ НЕ ИСПОЛЬЗОВАН на 20.08.2020
Люциферин эвфаузид + protein F in vitro - 476 нм, однако in vivo спектры люминесценции гомогенатов эвфаузид имеют четко выраженные пики в диапазоне E. pacifica и M. norvegica имеет бимодальный характер - в нем присутствует не только основной пик при 476 нм, но и менее интенсивный дополнительный между 520 и 540 нм. /Shimom. p.81/
Окисление люциферина динофлагеллят: автоокисление (ПРОВЕРИТЬ! - на схеме - присоединение воды к енамину) и катализируемое люциферазой окисление до сопряженного α-дикетона
Динофлагелляты - тетрапирролы, окисление ведёт к голубому свечению.
Также у ракообразных отряда эвфаузиевых (питание динофлагеллятами????)
Имидазопиразины морских беспозвоночных
[править | править код]То, что перенесено в осн. статью 20.08.2020
[править | править код]
В биолюминесцентных системах морских организмов самых различных таксонов - от кишечнополостных до ракообразных - широко распространны люциферины, в основе структуры которых лежит имидазопиразиновое ядро[11]. Вместе с тем, такое таксономическе разнообразие ведёт и к разнообразию имидазопиридазиновых биолюминесцентных систем ведёт к тому, что в качестве люциферина выступают, по меньшей мере, четыре формы имидазопиразинов:
- варгулин ракушковых ракообразных (Ostracoda);
- целентеразин книдарий и щетинкочелюстных[20];
- дисульфат целентеразина, являющийся люциферином кальмаров-светлячков Watasenia scintillans[21];
- пероксид целентеразина, выступающий в роли функциональной группы белков экворина и обелина обелий
- дегидроформа в составе симплектина - фотопротеина кальмаров.
Черновик
[править | править код]


Целентеразин широко распространён в биолюминесцентных системах морских организмов самых различных таксонов - от кишечнополостных до ракообразных. Вместе с тем, такое таксономическе разнообразие ведёт и к разнообразию имидазопиридазиновых биолюминесцентных систем ведёт к тому, что в качестве люциферина выступают, по меньшей мере, четыре формы целентеразина /Shimom. p.xxv/:
целентеразинваргулин ракушковых ракообразных (Ostracoda) - неферментативная хемолюминесценция при окислении кислородом воздуха водных растворов, λmax - 448-463 нм (в зависимости от pH, /Shimom. p.64/), механизм реакции - дегидрирование пиразинового азота с присоединением кислорода с образованимем гидропероксида и раскрытием имидазо-цикла /Shimom. p.69/, оксилюциферин не флуоресцирует, но его комплекс с люциферазой - яркая флуоресценция, спектрально близкая с биолюминесценцией /Shimom. p.67/- дисульфат целентеразина, являющийся люциферином кальмаров-светлячков Watasenia scintillans К. Н. Несис. Ватасения - кальмар-светлячок. Природа. 1998. №12. С.61-66
- пероксид целентеразина, выступающий в роли функциональной группы белков экворина и обелина (Обелия)
- дегидроформа в составе симплектина - фотопротеина кальмаров
/Разобраться - Masaki Kuse. Chromophores in photoproteins of a glowing squid and mollusk https://www.tandfonline.com/doi/pdf/10.1080/09168451.2014.915724 : у Aequoria aequoria целентеразин, но в составе экворина - пероксид целентеразина как простетическая группа; у Watasenia scintillans - дегидроцелентеразин, присоединяющийся к симплектину по Cys-SH/
У большинства кишечнополостных (Coelenterates) и щетинкочелюстных (Chaetognatha), обитающих в море - целентеразин, у медуз Aequorea и гидроидных обелий целентеразин выполняет роль простетической группы фотопротеинов - экворина и обелина.
- КФ 1.13.12.5 англ. Renilla-luciferin 2-monooxygenase
- КФ 1.13.12.8 Watasenia-люциферин 2-монооксигеназа англ. Watasenia-luciferin 2-monooxygenase
- КФ 1.13.12.13 англ. Oplophorus-luciferin 2-monooxygenase - en:Oplophorus-luciferin 2-monooxygenase, глубоководные планктонные креветки семейства Oplophorida en:Oplophoridae
Бензотиазольный люциферин насекомых
[править | править код]Насекомые - люциферин - бензотиазол, зеленоватое и желтое свечение Биосинтез (и не только его) - http://chemspace.tumblr.com/post/92134935785/biosynthesis-of-luciferin


-
Альдегидные люциферины червей
[править | править код]
Среди кольчатых червей биолюминесцентные виды встречаются у двух классов - морских полихет и у обитающих на суше олигохет.
Природа биолюминесцентных комплексов полихет в настоящее время остается неизвестной, в случае олигохет Diplocardia Longa в качестве люциферина был идентифицирован простой алифатический аминоальдегид - N-изоварелил-3-амино-1- пропаналь. Реакция начинается с присоединения перекиси водорода к альдегидной группе люциферина с образованием пероксиполуацеталя, который под действием люциферазы распадается с излучением света[22]. Люцифераза Diplocardia представляет собой металлофермент с молекулярной массой ~300 КДа, содержащий одновалентную медь. Особенностью химизма биолюминесценции Diplocardia, отличающего его от большинства биолюминесцентных механизмов, является участие в роли окислителя не кислорода, а перекиси водорода - то есть в данном случае люцифераза обладает пероксидазоподобной активностью. Подобный пероксидазный механизм биолюминесценции предполагается и у полухордовых - в частности, желудевых червей Balanoglossus bimiensis in vitro люцифераза может быть заменена пероксидазой хрена[23].
ВЫШЕ - перенесено в осн. ст. 20.08.2020
Альдегидные люциферины моллюсков
[править | править код]
Новозеландские брюхоногие моллюски Latia neritoides, выделяющие светящуюся зеленым светом слизь, примечательны тем, что в настоящее время (2009 г.) являются единственным известным видом пресноводных моллюсков, способных к биолюминесценции. Люциферином является формиат енольной формы терпенового альдегида, который окисляется до дигидро-β-ионона, муравьиной кислоты и углекислого газа. Было синтезировано несколько аналогов, содержащих енолформиатную и енолацетатную группу и было показано, что триметилциклогексановое кольцо люциферина является необходимым структурным фрагментом для люминесценции при окислении [24]. Люцифераза (Latia-люциферин-2-монооксигеназа (деметилирующая), КФ 1.14.99.21) представляет собой белок с молекулярной массой ~170 КДа, в реакции также участвует «пурпурный белок» с молекулярной массой ~40 КДа (Shimom. p. 187). Роль «пурпурного белка» пока неясна, он участвует в реакции не в стехиометрических, а каталитических количествах и может быть заменен аскорбатом + NADH, предполагается, что он участвует в регенерации одного из субстратов люциферин-люциферазной системы. Первоначально предполагалось, что «пурпурный белок» может являться эмиттером в процессе люминесценции Latia[25], однако это предположение не подтвердилось[26].
ВЫШЕ - перенесено в осн. ст. 20.08.2020
Фотопротеины
[править | править код]
См. http://photobiology.info/Lee-Vysotski.html Симплектин кальмаров symplectin
Люциферазы
[править | править код]А. А. Котлобай et al. Палитра люцифераз: природные инструменты для новых методов в биомедицине. Acta Naturae, Том 12 № 2 (45) 2020 - обзор рюцифераз люциферин- и целентеразин-зависимых люцифераз + люц. бактерий с указаниями видов и Л макс
Л-Л системы Perspectives on Bioluminescence Mechanisms
https://onlinelibrary.wiley.com/doi/full/10.1111/php.12650
Фотофоры и регуляция биолюминесценции
[править | править код]Фотофоры:
Фрагменты: https://www.sciencedirect.com/topics/agricultural-and-biological-sciences/photophore
Головоногие, морфология, схема: http://tolweb.org/accessory/Cephalopod_Photophore_Terminology?acc_id=2015 https://en.wikipedia.org/wiki/Counter-illumination
Photinus http://ase.tufts.edu/biology/Firefly/
Биологическая роль
[править | править код]Динофлагелляты - гипотеза «аварийной сигнализации» (англ. Burgular Alarm Hypothesis): копеподы, кормясь динофлагеллятами, вызывают их свечение, свечение, в свою очередь, привлекает хищников, питающихся копеподами [27] , [28].
Bioluminescence in the Sea - Literature Review (PDF Available) in Annual Review of Marine Science 2(1):443-93 · January 2010 В т.ч. таксономич. распр. и биол. функц. HTML вариант https://digitalcommons.calpoly.edu/cgi/viewcontent.cgi?article=1186&context=bio_fac&httpsredir=1&referer=
Selected Least Studied but not Forgotten Bioluminescent Systems https://onlinelibrary.wiley.com/doi/full/10.1111/php.12704?hootPostID=4e9083e0e3d0df3033ec82d28061b2d4
Применения
[править | править код]BRET (англ. bioluminescence resonance energy transfer) uses a bioluminescent luciferase that is genetically fused to one candidate protein, and a green fluorescent protein mutant fused to another protein of interest. Interactions between the two fusion proteins can bring the luciferase and green fluorescent protein close enough for resonance energy transfer to occur, thus changing the color of the bioluminescent emission (A. P. Demchenko. Introduction to Fluorescence Sensing, 8.2.3 - BRET)
Фолазин, фотопротеин моллюсков Pholas dactilus (с которыми работал Дюбуа) используется в исслелованиях окислительного стресса: он окисляется различными АФК (супероксид анион-радикал, хлорноватичтая кислота) и его люминесценция на два порядка интенсивнее люминесценции люминола в такой же концентрации [29].
Примечания
[править | править код]- ↑ Anderson, James Michael (1980). "BIOCHEMISTRY OF CENTIPEDE BIOLUMINESCENCE*". Photochemistry and Photobiology. 31 (2): 179–181. doi:10.1111/j.1751-1097.1980.tb03701.x. Дата обращения: 9 марта 2010.
- ↑ Kuse, Masaki (2001). "7,8-Dihydropterin-6-carboxylic acid as light emitter of luminous millipede, Luminodesmus sequoiae". Bioorganic & Medicinal Chemistry Letters. 11 (8): 1037–1040. doi:10.1016/S0960-894X(01)00122-6. ISSN 0960-894X. Дата обращения: 9 марта 2010.
((cite journal)): Неизвестный параметр|coauthors=игнорируется (|author=предлагается) (справка) - ↑ Herring, Peter J. (1985-11). "Bioluminescence in the Crustacea". Journal of Crustacean Biology. 5 (4): 557–573. ISSN 0278-0372. Дата обращения: 9 марта 2010.
- ↑ Herring, Peter J. (1976). "Bioluminescence in Decapod Crustacea". Journal of the Marine Biological Association of the UK. 56 (04): 1029–1047. doi:10.1017/S0025315400021056. Дата обращения: 21 июня 2010.
- ↑ Shimomura, Osamu (1957). "Crystalline Cypridina Luciferin". Bulletin of the Chemical Society of Japan. 30 (8): 929–933. doi:10.1246/bcsj.30.929. ISSN 0009-2673. Дата обращения: 6 января 2010.
((cite journal)): Неизвестный параметр|coauthors=игнорируется (|author=предлагается) (справка) - ↑ Viviani, Vadim R. (1999). "Cloning, Sequence Analysis, and Expression of Active Phrixothrix Railroad-Worms Luciferases: Relationship between Bioluminescence Spectra and Primary Structures†,‡". Biochemistry. 38 (26): 8271–8279. doi:10.1021/bi9900830. Дата обращения: 5 января 2010.
((cite journal)): Неизвестный параметр|coauthors=игнорируется (|author=предлагается) (справка) - ↑ Ugarova, N. N. (2005). "Bioluminescence Spectra of Native and Mutant Firefly Luciferases as a Function of pH". Biochemistry (Moscow). 70 (11): 1262–1267. doi:10.1007/s10541-005-0257-2. ISSN 0006-2979. Дата обращения: 5 января 2010.
((cite journal)): Неизвестный параметр|coauthors=игнорируется (|author=предлагается) (справка) - ↑ 1 2 А. А. Котлобай et al. Палитра люцифераз: природные инструменты для новых методов в биомедицине. Acta Naturae, Том 12 № 2 (45) 2020
- ↑ Ugarova, N. N. (2005). "Bioluminescence Spectra of Native and Mutant Firefly Luciferases as a Function of pH". Biochemistry (Moscow). 70 (11): 1262–1267. doi:10.1007/s10541-005-0257-2. ISSN 0006-2979. Дата обращения: 5 января 2010.
((cite journal)): Неизвестный параметр|coauthors=игнорируется (|author=предлагается) (справка) - ↑ H Morise, O Shimomura, FH Johnson, J Winant: Intermolecular Energy Transfer in Bioluminescent systems of aequorea. Biochemistry 13 (1974) 2656-62.
- ↑ 1 2 3 Aubin Fleiss and Karen S. Sarkisyan. A brief review of bioluminescent systems (2019). Curr Genet. 2019; 65(4): 877–882. PMID: 30850867
- ↑ E. A. Meighen, P. V. Dunlap. Physiological, Biochemical and Genetic Control of Bacterial Bioluminescence // Rose, Anthony H. Advances in Microbial Physiology, Vol. 34. — Academic Press, 1993-01-01. — ISBN 0120277344, 9780120277346.
- ↑ Strehler B.L., Cormier M.J. Arch. Biochem. and Biophys., 1953, v.17, №1, p.16-33
- ↑ Cormier M.J., Strehler B.L. J. Amer. Chem. Soc., 1953, v.75, №5, p. 4864-4865
- ↑ Fisher, Andrew J. (1996). "The 1.5-Å Resolution Crystal Structure of Bacterial Luciferase in Low Salt Conditions". Journal of Biological Chemistry. 271 (36): 21956–21968. doi:10.1074/jbc.271.36.21956. Дата обращения: 1 мая 2010.
((cite journal)): Неизвестный параметр|coauthors=игнорируется (|author=предлагается) (справка)Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑
Uyakul, Duangchan (1989). "Lampteromyces bioluminescence : 3. Structure of lampteroflavin, the light emitter in the luminous mushroom, L. japonicus". Bioorganic Chemistry. 17 (4): 454–460. doi:10.1016/0045-2068(89)90046-1. ISSN 0045-2068. Дата обращения: 11 мая 2011.
((cite journal)): Неизвестный параметр|coauthors=игнорируется (|author=предлагается) (справка) - ↑ Vladimir S. Bondar, Osamu Shimomura and Josef I. Gitelson. Luminescence of Higher Mushrooms. Journal of Siberian Federal University. Biology 4 (2012 5) 331-351
- ↑ Alexey A. Kotlobay et al. Genetically encodable bioluminescent system from fungi. PNAS December 11, 2018 115 (50) 12728-12732; 2018 https://doi.org/10.1073/pnas.1803615115
- ↑ Alexey A. Kotlobay et al. Genetically encodable bioluminescent system from fungi. PNAS December 11, 2018 115 (50) 12728-12732; 2018 https://doi.org/10.1073/pnas.1803615115
- ↑ ;Erik V Thuesen et al. Bioluminescent Organs of Two Deep-Sea Arrow Worms, Eukrohnia fowleri and Caecosagitta macrocephala, With Further Observations on Bioluminescence in Chaetognaths. Biological Bulletin 219(2):100-11 (2010)
- ↑ К. Н. Несис. Ватасения - кальмар-светлячок. Природа. 1998. №12. С.61-66
- ↑ Ohtsuka, Hiroko (1976). "Structural identification and synthesis of luciferin from the bioluminescent earthworm, Diplocardia longa". Biochemistry. 15 (5): 1001–1004. doi:10.1021/bi00650a009. Дата обращения: 6 января 2010.
((cite journal)): Неизвестный параметр|coauthors=игнорируется (|author=предлагается) (справка) - ↑ L. S. Dure, M. J. Cormier. Studies on thr bioluminescence of 'Balanoglossus bimiensis. Evidence for peroxidase nature of balanoglossus luciferase. J. Biol. Chem. 238:790-793 (1963)
- ↑ Nakamura, Mitsuhiro (2005). "Bioluminescence activity of Latia luciferin analogues: replacement of the 2,6,6-trimethylcyclohexene ring onto the methyl-substituted phenyl groups". Tetrahedron Letters. 46 (1): 53–56. doi:10.1016/j.tetlet.2004.11.043. ISSN 0040-4039. Дата обращения: 3 мая 2010.
((cite journal)): Неизвестный параметр|coauthors=игнорируется (|author=предлагается) (справка) - ↑ Мецлер. Биохимия живой клетки, т.3, стр. 73. М.: Мир, 1980
- ↑ S. Kojima et al. Molecular Bases on Latia Bioluminescence. Symposium on the Chemistry of Natural Products (2000). Symposium Papers.
- ↑
Abrahams, Mark V. (1993-01). "Bioluminescence in Dinoflagellates: A Test of the Burgular Alarm Hypothesis". Ecology. 74 (1): 258–260. ISSN 0012-9658. Дата обращения: 26 августа 2010.
((cite journal)): Неизвестный параметр|coauthors=игнорируется (|author=предлагается) (справка) - ↑
Mesinger, A. F. (1992). "Dinoflagellate luminescence increases susceptibility of zooplankton to teleost predation". Marine Biology. 112 (2): 207–210. doi:10.1007/BF00702463. ISSN 0025-3162. Дата обращения: 26 августа 2010.
((cite journal)): Неизвестный параметр|coauthors=игнорируется (|author=предлагается) (справка) - ↑ J. Arnhold. REVIEW: Properties, Functions, and Secretion of Human Myeloperoxidase Biochemistry (Moscow), Volume 69 (2004), Number 1
NS
[править | править код]- О конкретном примере :-) -- см. последнюю фразу первого абзаца в Белые карлики // Физика космоса: Маленькая энциклопедия. — М.: Советская энциклопедия, 1986.. Я уточнил ссылку до конкретной статьи в "Физике космоса" + URL-а раздела "Б".
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.