Wikipedysta:CFCF/brudnopis/Rak płuc
 A plane chest X-ray showing a tumor in the lung (marked by arrow) | |
| Klasyfikacje | |
| DiseasesDB | |
|---|---|
| MedlinePlus | |
| MeSH | |
Rak płuc jest chorobą charakteryzującą się niekontrolowanym wzrostem komórek tkanek płucnych. Nieleczony nowotwór rozprzestrzenia się poza płuco do okolicznych tkanek oraz innych części ciała; proces nazywa się przerzutem. Większość nowotworów złośliwych rozwijających się w płucach, czyli pierwotnych nowotworów złośliwych płuc, stanowią raki powstające w komórkach nabłonkowych. Głównymi typami nowotworów złośliwych płuc są: rak drobnokomórkowy (skrót ang. SCLC), zwany również drobnoziarnistym, oraz rak niedrobnokomórkowy (skrót ang. NSCLC). Najczęstsze objawy to kasłanie (w tym krwioplucie), utrata masy ciała i duszności.[1]
Najczęstszą przyczyną raka płuc jest długotrwały kontakt z dymem tytoniowym,[2] który odpowiada za 80-90% zachorowań.[1] Niepalący stanowią 10-15% przypadków występowania raka płuc.[3] W tych przypadkach najczęstsze przyczyny powstawania choroby to działanie czynników dziedzicznych,[4] narażenie na szkodliwe działanie radonu,[4] azbestu,[5] oraz zanieczyszczonego powietrza[4] (włącznie ze środowiskowym dymem tytoniowym).[6][7] Rak płuc może być rozpoznany na podstawie badania RTG klatki piersiowej i tomografii komputerowej. Rozpoznanie potwierdza się przeprowadzając biopsję[8]; zazwyczaj ma ona miejsce podczas wykonywania bronchoskopii lub tomografii komputerowej. Leczenie i rokowanie uzależnione są od typu raka, jego stopnia zaawansowania (stopnia rozprzestrzenienia) oraz ogólnego stanu zdrowia pacjenta mierzonego za pomocą skali sprawności (twz. Skali Karnofsky’ego).
Najczęściej stosowane metody leczenia to: leczenie operacyjne, chemoterapia, i radioterapia. Rak niedrobnokomórkowy leczony jest zazwyczaj chirurgicznie, natomiast rak drobnokomórkowy reaguje lepiej na chemoterapię i radioterapię.[9] 15% pacjentów w Stanach Zjednoczonych przeżywa pięć lat od daty rozpoznania raka płuc.[10] Spośród nowotworów złośliwych występujących u obu płci na całym świecie rak płuc jest najczęstszą przyczyną zgonów ( 1,38 milliona zgonów w roku 2008).[11] Szablon:TOC limit
Objawy
[edytuj | edytuj kod]Objawy, które mogą wskazywać na raka płuc, to:[1]
- symptomy generowane przez układ oddechowy: kaszel, krwioplucie, świszczący oddech lub brak tchu
- symptomy ogólnoustrojowe: utrata masy ciała, gorączka, pałeczkowatość palców oraz zmęczenie
- symptomy związane z uciskiem miejscowym: ból w klatce piersiowej, ból w kościach, zespół żyły głównej górnej, utrudnienie połykania
Jeżeli rozrost raka powoduje zwężenie światła dróg oddechowych, może to prowadzić do utrudnienia w przepływie powietrza, które skutkuje trudnością w oddychaniu. Niedrożność dróg oddechowych może również prowadzić do gromadzenia się wydzielin za miejscem blokady i zwiększenia ryzyka wystąpienia zapalenia płuc.[1]
Zależnie od typu nowotworu mogą również wystąpić objawy paranowotworowe sugerujące obecność procesu nowotworowego.[12] W przypadku raka płuc spotykane są następujące zaburzenia paranowotworowe: zespół Lamberta–Eatona (osłabienie mięśni spowodowane autoprzeciwciałami), hiperkalcemia lub zespół niewłaściwego uwalniania wazopresyny (skrót ang. SIADH). Nowotwory rozwijające się w okolicy szczytu płuca, zwane guzami Pancoasta, naciekają sąsiadujący pień współczulnego układu nerwowego prowadząc do wystąpienia zespołu Hornera (opadania powieki górnej i zwężenia źrenicy oka po stronie uszkodzenia) oraz uszkodzenia splotu ramiennego.[1]
Wiele z objawów raka płuc (zmniejszenie apetytu, utrata masy ciała, gorączka, zmęczenie) to objawy niecharakterystyczne.[8] W wielu przypadkach pojawienie się objawów i zgłoszenie się do lekarza następuje długo po rozprzestrzenieniu się raka poza jego pierwotne umiejscowienie. Najczęstsze miejsca przerzutów to: drugie płuco, mózg, kości, gruczoły nadnerczowe, wątroba, osierdzie oraz nerki.[13] U około 10% chorych na raka płuc choroba przebiega bezobjawowo i najczęściej zostaje rozpoznana przypadkowo w trakcie rutynowego prześwietlenia klatki piersiowej.[10]
Przyczyny
[edytuj | edytuj kod]Rak powstaje na skutek uszkodzenia DNA. Uszkodzenie materiału genetycznego prowadzi do zaburzenia normalnych funkcji komórki, takich jak namnażanie, zaprogramowana śmierć (apoptoza) czy reperacja DNA. Nagromadzanie się tych uszkodzeń zwiększa ryzyko wystąpienia raka.[14]
Palenie
[edytuj | edytuj kod]
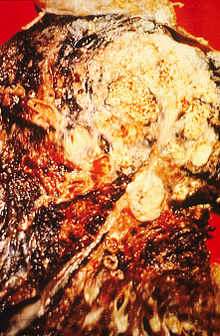
Palenie, zwłaszcza palenie papierosów, jest głównym czynnikiem powodującym zachorowanie na raka płuc.[15] Dym papierosowy zawiera ponad 60 znanych substancji rakotwórczych,[16] takich jak nitrozoamina, benzopiren i izotopy promieniotwórcze pochodzące z rozpadu radonu. Nikotyna podejrzewana jest również o hamowanie odpowiedzi immunologicznej organizmu na nowotwory rozwijające się w tkankach narażonych na jej działanie.[17] W roku 2000 w krajach rozwiniętych odsetek zachorowań na raka płuc przypisywanych wpływowi palenia tytoniu wynosił 90% u mężczyzn (70% u kobiet).[18] Inne dane wskazują, że palenie tytoniu odpowiedzialne jest za 80–90% zachorowań na raka płuc.[1]
Palenie bierne, czyli wdychanie dymu z wyrobu tytoniowego palonego przez inną osobę, stanowi przyczynę raka płuc u osób niepalących. Za osobę palącą biernie uważa się kogoś, kto mieszka lub pracuje z osobą palącą. Badania przeprowadzone w Stanach Zjednoczonych, [19][20]Europie, [21] Wielkiej Brytanii,[22] i Australii[23] jednoznacznie wykazały istotnie zwiększone ryzyko raka płuc u osób narażonych na palenie bierne.[24] Ryzyko zachorowalności zwiększa się o 20–30% w przypadku osób mieszkających z osobami palącymi, natomiast o 16–19% w przypadku osób pracujących z osobami palącymi.[25] Badania dotyczące wpływu bocznego strumienia dymu tytoniowego na zdrowie osoby niepalącej wskazują, że jest on znacznie bardziej niebezpieczny niż strumień główny.[26] W Stanach Zjednoczonych, bierne palenie powoduje około 3400 zgonów rocznie.[20]
Radon
[edytuj | edytuj kod]Radon jest bezbarwnym i bezwonnym gazem powstającym w wyniku rozpadu radioaktywnego radu, który jest produktem rozpadu uranu występującego naturalnie w skorupie ziemskiej. Produkty rozpadu promieniotwórczego jonizują materiał genetyczny powodując powstawanie mutacji, które mogą czasami okazać się rakotwórcze. Kontakt z radonem jest drugą, po paleniu, przyczyną powstawania raka płuc w Stanach Zjednoczonych.ref name="Alberg" /> Ryzyko zachorowalności wzrasta o 8–16% przy zwiększeniu stężenia radonu skutkującego wzrostem promieniowania o 100 Bq/m³.[27] Stężenie radonu w środowisku waha się w zależności od składu gleby i skał. Na przykład w Kornwalii w Wielkiej Brytanii (gdzie podłoże zbudowane jest głównie z granitu) występują poważne problemy z wysokim stężeniem radonu i w związku z tym w celu jego obniżenia budynki muszą być dobrze wentylowane. Według oceny amerykańskiej Agencji Ochrony Środowiska (ang. skrót EPA) w jednym na 15 domów poziom radonu przekracza bezpieczny limit wynoszący 4 pikokiury na litr (pCi/l) (148 Bq/m³).[28]
Azbest
[edytuj | edytuj kod]Azbest może być przyczyną szeregu chorób płuc, w tym raka. W przypadku raka płuc palenie tytoniu i azbest działają synergistycznie.[5] Azbest może także powodować nowotwór złośliwy opłucnej zwanymiędzybłoniakiem (inny niż rak płuc).[29]
Zanieczyszczenie powietrza
[edytuj | edytuj kod]Wpływ zanieczyszczenia powietrza atmosferycznego na zwiększenie ryzyka raka płuc jest stosunkowo mały.[4] Drobne cząstki stałe (PM2.5) i aerozole siarczanowe uwalniane ze spalinami samochodowymi związane są z niewielkim zwiększeniem ryzyka zachorowalności.[4][30] W przypadku dwutlenku azotu, stopniowe zwiększenie stężenia o 10 cząstek na miliard zwiększa ryzyko raka płuc o 14%.[31] Szacuje się, że zanieczyszczenie powietrza atmosferycznego odpowiedzialne jest za 1-2% przypadków raka płuc.[4]
Wstępne wyniki badań potwierdzają zwiększone ryzyko powstawania raka płuc wywołanego zanieczyszczeniem powietrza w pomieszczeniach zamkniętych. Jest to związane ze spalaniem drewna, węgla drzewnego, łajna i odpadów w celach grzewczych i do gotowania.[32] U kobiet narażonych na kontakt z dymem palonego węgla w pomieszczeniach zamkniętych ryzyko zachorowalności na raka płuc zwiększa się dwukrotnie. Szereg ubocznych produktów spalania biomasy należy również do substancjii rakotwórczych (potwierdzonych lub podejrzewanych).ref name=Sood2012/> Wynikające z tego ryzyko zachorowalności na raka płuc dotyczy około 2,4 miliarda ludzi na całym świecie[32] i jest odpowiedzialne za 1,5% przypadków występowania tej choroby.[33]
Czynniki dziedziczne
[edytuj | edytuj kod]Szacuje się, że około 8 do 14% przypadków raka płuc spowodowanych jest czynnikami dziedzicznymi.[34] Ryzyko wystąpienia choroby u krewnych osób cierpiących na raka płuc jest 2,4 razy większe. Jest to najprawdopodobniej spowodowane kombinacją genów.[35]
Inne przyczyny
[edytuj | edytuj kod]Z rakiem płuc łączy się wiele różnych substancji, zawodów oraz czynników środowiskowych. Międzynarodowa Agencja Badania Raka (IARC) uważa, że istnieje wystarczający „materiał dowodowy” wskazujący na rakotwórcze działanie następujących czynników:[36]
- Niektóre metale (produkcja aluminium, kadm oraz związki zawierające kadm, związki zawierające chrom(VI), beryl oraz związki zawierające beryl, odlewy żelazne oraz stalowe, związki zawierające nikiel, arszenik oraz nieorganiczne związki zawierające arszenik, podziemne wydobycie hematytu)
- Niektóre produkty spalania (spalanie niecałkowite, węgiel (przedostawanie się produktów spalania węgla do gospodarstwa domowego), gazyfikacja węgla, smoła węglowa, produkcja koksu, sadza, wydmuchy z silnika wysokoprężnego)
- Promieniowanie jonizujące (promieniowanie rentgenowskie, radon-222 oraz produkty jego rozkładu, promieniowanie gamma, pluton)
- Niektóre trujące gazy (eter metylowy (technicznie czysty), eter di(chlorometylowy), iperyt siarkowy, MOPP (chemioterapia - MOPP), opary związane z malowaniem)
- Produkcja i krystalizacja gumy pył krzemionkowy
Patogeneza
[edytuj | edytuj kod]Podobnie jak w przypadku innych rodzajów raka, rak płuc powstaje w wyniku aktywacji onkogenów lub dezaktywacji antyonkogenów.[37] Onkogeny uważane są za czynnik sprzyjający zachorowaniu na raka. Uważa się, że protoonkogeny zamieniają się w onkogeny pod wpływem działania czynników rakotwórczych.[38] Mutacje protooktogenu K-ras odpowiedzialne są za 10–30% niedrobnokomórkowych przypadków raka płuc.[39][40] Receptor czynnika wzrostu naskórka (EGFR) kontroluje proliferację komórek, apoptozę, newaskularyzację oraz inwazję nowotworową.[39] Mutacja oraz amplifikacja EGFR jest powszechna w przypadku niedrobnokomórkowego raka płuc i stanowi podstawę leczenia przy użyciu inhibitorów EGFR. Znacznie rzadziej związane jest to z her2/neu.[39] Uszkodzenie chromosomów może prowadzić do spadku heterozygotyczności. Może to stanowić przyczynę dezaktywacji antyonkogenów. Uszkodzenie chromosomów 3p, 5q, 13q, oraz 17p są szczególnie częste w przypadku drobnokomórkowego raka płuc. Supresor nowotworowy p53, obecny w chromosomie 17p, zostaje dotknięty w 60-75% przypadków.[41] Wśród innych genów dotkniętych mutacją lub amplifikacją znajdują się c-MET, NKX2-1,LKB1, PIK3CA, and BRAF.[39]
Diagnoza
[edytuj | edytuj kod]
Radiografia klatki piersiowej jest jednym z pierwszy badań pozwalających stwierdzić, czy opisywane przez badanego objawy mogą wskazywać na raka płuc. Pozwala wykryć widoczne zmiany, poszerzenie śródpiersia (wskazujące na przerzuty na węzły chłonne), niedodmę (bezpowietrzność), zagęszczenia (zapalenie płuc) lub wysięk w opłucnej.[2] Tomografia komputerowa pozwala zazwyczaj zdobyć więcej informacji dotyczących rodzaju oraz stopnia rozwoju choroby. Bronchoskopia lub biopsja komputerowa pozwala pobrać próbkę zmian guzowych w celu przeprowadzenia badania histopatologicznego.[10]
Rak płuc na radiogramie przyjmuje często formę pojedynczego cienia okrągłego w płucu. Jednak diagnoza różnicowa obejmuje wiele zaburzeń. Podobne objawy mogą wskazywać na wiele innych chorób, w tym gruźlicę, infekcje grzybicze, rak z przerzutami lub kryptogenne organizujące się zapalenie płuc. Inne, mniej powszechne przyczyny pojedynczego cienia okrągłego, obejmują hamartomę, torbiele oskrzeli, gruczolaki, malformację tętniczo-żylną, sekwestrację płuca, guzki reumatoidalne, ziarniakowatość z zapaleniem naczyń i chłoniaki.[42] Rak płuc może zostać również wykryty przypadkowo jako pojedynczy cień okrągły płuca widoczny na radiogramie klatki piersiowej lub tomogramie komputerowym wykonanym w innym celu.[43] Ostateczna diagnoza raka płuc jest rezultatem badania histopatologicznego podejrzanej tkanki w związku z badaniem klinicznym i radiologicznym.[1]
Klasyfikacja
[edytuj | edytuj kod]| Typ histopatologiczny | Roczna wykrywalność u 100 000 badanych |
|---|---|
| Wszystkie typy | 66,9 |
| Gruczolakorak | 22,1 |
| Rak komórek płaskich nabłonka | 14,4 |
| Rak drobnokomórkowy | 9,8 |
Rak płuc klasyfikowany jest w oparciu o typ histologiczny.[8] Klasyfikacja raka jest istotna, ponieważ pozwala określić działanie oraz skuki choroby. Większość przypadków raka płuc to nowotwory złośliwe - zmiany związane z komórkami nabłonkowymi. Rak płuc jest również klasyfikowany w oparciu o rozmiar i występowanie komórek złośliwych zaobserwowanych przez histopatologa w czasie badania mikroskopem. Stosowane są dwie ogólne klasyfikacje – rak niedrobnokomórkowy oraz drobnokomórkowy.[44]
Niedrobnokomórkowy rak płuc
[edytuj | edytuj kod]
Trzy główne typy raka niedrobnokomórkowego obejmują gruczolakoraka, raka kolczystokomórkowego skóry oraz wielkokomórkowego raka płuc.[1]
40% przypadków stanowi gruczolakorak rozwijający się zazwyczaj w bocznej tkance płuc.[8] Większość przypadków gruczolakoraka ma związek z paleniem; jednak gruczolakorak jest również najczęściej występującą formą raka płuc u osób, które wypaliły w swoim życiu mniej niż 100 papierosów („niepalących”),[1].[45] Rodzajem gruczolakoraka jest rak oskrzelikowo-pęcherzykowy płuc występujący częściej u niepalących kobiet i charakteryzujący się dłuższym okresem przetrwania.[46]
Rak nabłonka płaskiego stanowi ok. 30% przypadków raka płuc. Najczęściej występuje w pobliżu rozległych dróg oddechowych. Wolna przestrzeń i związana z chorobą martwica komórkowa znajdują się często w środkowej części guza.[8] Rak wielkokomórkowy stanowi ok. 9% przypadków raka płuc. Jego nazwa związana jest z tym, że komórki rakowe są powiększone, występują w nich nadmiar cytoplazmy, duże jądra komórkowe oraz wyraźnie widoczne jąderka.[8]
Drobnokomórkowy rak płuc
[edytuj | edytuj kod]
W przypadku drobnokomórkowego raka płuc (SCLC) w komórkach zauważyć można duże zagęszczenie granulków neurowydzielniczych, czyli (pęcherzyków zawierających hormony neuroendokrynne), które wiążą ten rodzaj raka z zespołem endokrynnym/paraneoplastycznym.[47] Większość przypadków choroby rozwija się w dużych drogach oddechowych (oskrzela pierwszorzędowe i drugorzędowe).[10]Ten rodzaj raka rozwija się szybko i może być przyczyną przerzutów na wczesnym etapie choroby. U 60-70% pacjentów już w momencie wykrycia choroby występują przerzuty. Rak drobnokomórkowy jest bardzo mocno związany z paleniem.[1]
Inne
[edytuj | edytuj kod]Mimo, że najczęściej wyróżnia się cztery główne typy histologiczne, niektóre przypadki obejmują cechy różnych typów.[44] Występujące rzadko typy raka płuc to nowotwór gruczołów ślinowych, rakowiak płuc oraz rak niezróżnicowany.[1]
Przerzuty
[edytuj | edytuj kod]| Typ histologiczny | Immunobarwienie |
|---|---|
| Rak komórek płaskich nabłonka | CK5/6 pozytywnie CK7 negatywnie |
| Gruczolakorak | CK7 pozytywnie TTF-1 pozytywnie |
| Rak wielokokomórkowy | TTF-1 negatywnie |
| Small-cell carcinoma | TTF-1 pozytywnie CD56 pozytywnie Chromogranina pozytywnie Synaptofizyna pozytywnie |
Płuco jest częstym miejscem przerzutów z innych części ciała. Rak wtórny klasyfikowany jest zgodnie z miejscem pochodzenia; np. rak piersi z przerzutami płucnymi nazywany jest rakiem piersi z przerzutami. Przerzuty widoczne na radiogramie klatki piersiowej mają często charakterystyczny okrągły kształt.[48]
Pierwotny rak płuca jest często przyczyną przerzutów w obrębie mózgu, kości, wątroby oraz nadnercza.[8] Immunobarwienie biopsji pomaga często określić pierwotne źródło.[49]
Klasyfikacja zaawansowania
[edytuj | edytuj kod]Klasyfikacja zaawansowania nowotworów złośliwych płuc to ocena stopnia przerzutów raka z pierwotnego źródła. Stanowi jeden z czynników wpływających na rokowania oraz potencjalną terapię raka płuc.[1]
Początkowa ocena zaawansowania niedrobnokomórkowego raka płuc (NSCLC) obejmuje ocenę w oparciu o klasyfikację TNM. Podstawą klasyfikacji są czynniki: t (ang. tumor - guz), n (and. node – węzeł chłonny) oraz m(ang. metastasis - przerzuty odległe). Następnie, korzystając z elementów TNM, przypisywana jest odpowiednia grupa, zaczynając od raka utajonego, poprzez etapy 0, IA (jeden-A), IB, IIA, IIB, IIIA, IIIB oraz IV (cztery). Etapy pozwalają dobrać rodzaj leczenia oraz dokonać oceny rokowania.[50] Drobnokomórkowy rak płuc (SCLC) zazwyczaj klasyfikowany jest jako „ograniczony w rozwoju” (ograniczony do połowy klatki piersiowej, a w swoim zakresie do jednego dopuszczalnego obszaru objętego radioterapią) lub o „zaawansowanym rozwoju” (rozległa forma choroby).[1] Jednak, klasyfikacja i grupy TNM są przydatne przy ocenie rokowania.[50]
Zarówno w przypadku NSCLC jak i SCLC, dwoma ogólnymi stopniami oceny zaawansowania jest kliniczny i chirurgiczny stopień zaawansowania. Kliniczny stopień zaawansowania oceniany jest przed podjęciem działań chirurgicznych. Opiera się na wynikach badań przesiewowych (np. obrazowanie komputerowe oraz obrazowanie PET) oraz wyniki biopsji. Chirurgiczny stopień zaawansowania oceniany jest w czasie lub po zabiegu i opiera się zarówno na wynikach chirurgicznych jak i klinicznych, włączając w to pobrane chirurgicznie próbki węzłów chłonnych klatki piersiowej.[8]
Profilaktyka
[edytuj | edytuj kod]Profilaktyka jest najtańszym działaniem spowalniającym rozwój raka płuc. Choć w większości państw przemysłowe i domowe czynniki rakotwórcze zostały zidentyfikowane i zdelegalizowane, to palenie tytoniu nadal cieszy się popularnością. Przeciwdziałanie paleniu tytoniu jest podstawowym celem w ramach profilaktyki raka płuc, a rzucenie palenia jest istotnym dla całego procesu środkiem profilaktycznym.[51]
Zasady mające na celu ograniczenie biernego palenia tytoniu w miejscach publicznych jak np. restauracje i miejsca pracy stają się coraz bardziej powszechne w wielu zachodnich państwach.[52] Bhutan zdelegalizował palenie tytoniu w 2005 r., [53] podczas gdy Indie zakazały palenia w miejscach publicznych w październiku 2008 r.[54] Światowa Organizacja Zdrowia zwróciła się do rządów z prośbą o zakaz reklamowania tytoniu w celu wyeliminowania palenia papierosów wśród młodych. Ocena organizacji wskazuje na to, że taki zakaz pozwala zmniejszyć odsetek palących o 16%.[55]
Długoterminowa suplementacja witaminy A,[56][57] witaminy C,[56] witaminy D[58] lub witaminy E[56] nie zmniejsza zagrożenia rakiem płuc. Niektóre badania wykazały, że dieta bogata w warzywa i owoce pozwala zredukować zagrożenie,[20][59] ale prawdopodobnie wynika to z czynników zakłócających. Szczegółowe badania nie wykazały wspomnianego związku.[59]
Badania przesiewowe
[edytuj | edytuj kod]Badania przesiewowe to pojęcie obejmujące badania medyczne mające na celu wykrycie choroby u osób, u których nie wystąpiły objawy. Dostępne w zakresie raka płuc badania przesiewowe to badanie cytologiczne plwociny, radiografia klatki piersiowej (CXR) oraz tomografia komputerowa (TK; skrót ang. CT). Stosowanie programów badań przesiewowych z wykorzystaniem CXR oraz badania cytologicznego okazało się nieskuteczne.[60] Badania przesiewowe osób z grupy wysokiego ryzyka (osoby w wieku od 55 do 79 lat palące już ponad 30 paczkolat oraz osoby cierpiące już wcześniej na raka płuc) prowadzone co roku przy wykorzystaniu niskodawkowej tomografii komputerowej pozwalają zmniejszyć bezwzględne ryzyko śmierci w wyniku raka płuc o 0,3% (względne o 20%).[61][62] Stwierdzono jednak wysoki odsetek fałszywych pozytywnych wyników badania, które mogą skutkować niepotrzebnym inwazyjnym leczeniem wiążącym się również z wysokim kosztem.[63] Na każdy prawdziwy i pozytywny wynik przypada 19 fałszywych pozytywnych wyników.[64] Innym zagrożeniem związanym z badaniami przesiewowymi jest wystawienie na promieniowanie.[65]
Leczenie
[edytuj | edytuj kod]Leczenie raka płuc jest zależne od rodzaju komórki dotkniętego chorobą, stopnia rozwoju oraz wyników danej osoby. Wykorzystywane często formy leczenia obejmują opiekę paliatywną,[66] zabiegi chirurgiczne, chemioterapię oraz radioterapię.[1]
Zabiegi chirurgiczne
[edytuj | edytuj kod]
W przypadku popartej badaniem diagnozy niedrobnokomórkowego raka płuc (NSCLC) przeprowadzana jest ocena jego rozwoju tak, aby dowiedzieć się, czy choroba rozwija się w jednym miejscu i może zostać przeprowadzony zabieg chirurgiczny, czy też przerzuty są już zbyt rozległe i leczenie chirurgiczne nie jest możliwe. Metodami wykorzystywanymi w celu dokonania oceny są tomografia komputerowa oraz pozytonowa emisyjna tomografia komputerowa.[1] W przypadku podejrzenia przerzutów do węzłów chłonnych możliwe jest przeprowadzenie mediastinoskopii w celu uzyskania próbki z węzłów oraz oceny rozwoju choroby.[67] Badanie krwi oraz badanie czynnościowe płuc są często używane w celu oceny tego czy pacjent może zostać poddany leczeniu chirurgicznemu.[10] W przypadku, gdy badanie czynnościowe płuc wykaże małą rezerwę oddechową, przeprowadzenie zabiegu chirurgicznego nie będzie możliwe.[1]
W większości przypadków NSCLC wykrytych na wczesnym stadium najczęściej przeprowadzanym zabiegiem jest usunięcie płata płuc (lobektomia). Osoby, u których przeprowadzenie pełnej lobektomii nie jest możliwe, dokonuje się mniej rozległego zabiegu wycięcia podpłatowego (resekcja częściowa). Jednak w porównaniu z lobektomią resekcja częściowa wiąże się z podniesionym ryzykiem ponownego wystąpienia choroby.[68] Brachyterapia radioaktywnym jodem przy granicy wycinka może zmniejszyć zagrożenie nawrotu choroby.[69] W rzadkich przypadkach konieczne jest usunięcie całego płuca (pneumonektomia).[68] Zabieg chirurgiczny wspomagany widerotorakoskopią oraz lobektomia VATS stanowią możliwie małoinwazyjną formę chirurgicznego zabiegu mającego na celu wyleczenie raka płuc.[70] Lobektomia VATS jest równie skuteczną metodą jak konwencjonalna lobektomia i wiąże się ze zmniejszonym ryzykiem chorób pooperacyjnych.[71]
W przypadku raka drobnokomórkowego (SCLC) zazwyczaj stosuje się chemioterapię oraz/lub radioterapię.[72] Prowadzone są badania w zakresie skuteczności leczenia chirurgicznego przypadku wcześnie wykrytego SCLC, które może poprawić wyniki chorego jeśli stosowane jest wraz z chemioterapią i radioterapią.[73]
Radioterapia
[edytuj | edytuj kod]Radioterapia jest bardzo często stosowana wraz z chemioterapią i może być metodą leczenia pacjentów z niedrobnokomórkowym rakiem płuc (NSCLC), których nie można poddać leczeniu chirurgicznemu. Taka forma intensywnej radioterapii bywa nazywana radioterapią radykalną.[74] Udoskonaloną wersją tej metody jest ciągła przyspieszona hiperfrakcjonowana radioterapia (CHART), w ramach której w krótkim okresie czasu prowadzona jest intensywna radioterapia.[75] Pooperacyjna radioterapia klatki piersiowej nie powinna być stosowana po chirurgicznym zabiegu mającym na celu usunięcie NSCLC.[76] Stosowanie radioterapii po leczeniu chirurgicznym może być korzystne w przypadku niektórych pacjentów z przerzutami na węzły chłonne N2.[77]
W przypadku możliwych do wyleczenia raków drobnokomórkowych (SCLC) często oprócz chemioterapii zaleca się radioterapię klatki piersiowej.[8]
Jeżeli rozwój raka blokuje krótki odcinek oskrzeli, możliwe że konieczne będzie przeprowadzenie w bezpośrednio w drogach oddechowych brachyterapii (radioterapii miejscowej) mającej na celu ich udrożnienie.[78] W porównaniu z zewnętrzną radioterapią wiązkami, brachyterapia pozwala skrócić czas leczenia i zredukować stopień wystawienia personelu medycznego na działanie promieniowania.[79]
Profilaktyczne napromieniowanie mózgowia (PCI) to metoda radioterapii obejmująca mózg, wykorzystywana w celu zmniejszenia ryzyka przerzutów. PCI jest metodą najbardziej przydatną przy SCLC. W przypadku ograniczonego stopnia rozwoju choroby PCI obniża śmiertelność na przestrzeni trzech lat z 20% do 15%; w przypadku zaawansowanej choroby śmiertelność zostaje na przestrzeni roku z 27% do 13%.[80]
Niedawne udoskonalenia w zakresie namierzania i obrazowania pozwoliły na rozwój radioterapii stereotaktycznej stosowanej na wczesnym etapie rozwoju raka płuc. Radioterapia stereotaktyczna polega na emitowaniu wysokich dawek przy małej liczbie sesji wykorzystując metody namierzania stereotaktycznego. Zazwyczaj stosuje się ją u pacjentów, których nie można poddać leczeniu chirurgicznemu w związku z współwystępowaniem innych chorób.[81]
Zarówno w przypadku pacjentów z NSCLC jak i SCLC możliwe jest stosowanie niewielkich dawek promieniowania w obrębie klatki piersiowej w celu ograniczenia objawów (radioterapia paliatywna).[82]
Chemioterapia
[edytuj | edytuj kod]Rodzaj chemoterapii jest zależny od typu raka.[8] Drobnokomórkowy rak płuca (SCLC), nawet na wczesnymn etapie rozwoju choroby, leczony jest głównie przy użyciu chemioterapii i napromieniania.[83] W przypadku SCLC najczęściej wykorzystuje się cisplatynę i etopozyd.[84] Są one łączone z karboplatyną, gemcytabiną,paklitakslem, winorelbiną, topotekanem i irynotekanem.[85][86] W przypadku zaawansowanego niedrobnokomórkowego raka płuc (NSCLC) chemioterapia obniża śmiertelność i jest często używana jako pierwsza forma leczenia pod warunkiem, że stan zdrowia pacjenta na to pozwala.[87] Zazwyczaj stosuje się dwa leki; podstawą jednego z nich jest platyna ( cisplatyna lub karboplatyna). Wśród innych często stosowanych leków znajduje się gemcytabina, paklitaksel, docetaksel,[88][89] pemetreksed,[90] etopozyd lub winorelbina.[89]
Chemioterapia adiuwantowa to pojęcie opisujące chemioterapię stosowaną po zabiegu chirurgicznym w celu poprawy rezultatów. W przypadku raka niedribnokomórkowego (NSCLC) z węzłów chłonnych pobierana jest w czasie zabiegu chirurgicznego próbka umożliwiająca przeprowadzenie oceny stopnia rozwoju choroby. W razie potwierdzenia II lub III stopnia choroby chemioterapia adjuwantowa zmniejsza śmiertelność przez okres pięciu lat o 5%.[91][92] Jednoczesne stosowanie winorelbiny oraz cisplatyny jest działaniem skuteczniejszym niż stosowanie innych kombinacji.[92] Chemioterapia adjuwantowa u osób przy stopniu raka IB jest kontrowersyjna, ponieważ próby kliniczne nie wykazały w wyraźnym stopniu obniżenia śmiertelności.[93][94] Próby w zakresie przedoperacyjnej chemioterapii przedoperacyjnej (chemioterapia neoadiuwantowa) w przypadku NSCLC nie dały jednoznacznego rezultatu.[95]
Opieka paliatywna
[edytuj | edytuj kod]U osób z nieuleczalną chorobą konieczna może być opieka paliatywna lub hospicyjna.[10] Ten rodzaj opieki pozwala omówić dodatkowe metody leczenia oraz zapewnia możliwość podjęcia przemyślanej decyzji; [96][97] pozwala także uniknąć nieskutecznego i kosztownego leczenia pod koniec życia.[97]
Chemioterapia może być stosowana wraz z opieką paliatywną w zakresie leczenia NSCLC. W zaawansowanych przypadkach odpowiednia chemioterapia pozwala wydłużyć przeciętną przeżywalność w porównaniu do stosowania wyłącznie leczenia podtrzymujące, a co więcej pozwala podnieść jakość życia.[98] Odpowiednia sprawność fizyczna oraz chemioterapia przy opiece paliatywnej w czasie leczenia raka płuc zapewnia od 1,5 do 3 miesięcy wydłużenia przeżywalności, złagodzenie objawów oraz poprawę jakości życia wraz z lepszymi rezultatami w wyniku stosowania nowoczesnych środków.[99][100] Grupa Współpracy w Zakresie Analizy Przerzutów NSCLC zaleca pacjentom, którzy chcą i są w stanie znieść chemioterapię, właśnie taką formę leczenia przy NSCLC.[87][101]
Rokowanie
[edytuj | edytuj kod]| Stopień zaawansowania klinicznego | Przyżywalność (%) | |
|---|---|---|
| Rak niedrobnokomórkowy | Rak drobnokomórkowy | |
| IA | 50 | 38 |
| IB | 47 | 21 |
| IIA | 36 | 38 |
| IIB | 26 | 18 |
| IIIA | 19 | 13 |
| IIIB | 7 | 9 |
| IV | 2 | 1 |
Rokowanie tego rodzaju choroby jest ogólne złe. Tylko 15% wszystkich osób cierpiących na raka płuc przeżywa okres pięciu lat od postawienia diagnozy.[2] Już w czasie postawienia diagnozy poziom rozwoju choroby jest często zaawansowany. W czasie wykrycia 30–40% przypadków raka nirdrobnokomórkowego (NSCLC) to poziom IV, podczas gdy dla raka drobnokomórkowego (SCLC) poziom IV stanowi 60% wykrywanych przypadków.[8]
Czynniki wpływające na rokowanie w przypadku obejmują obecność lub brak objawów płucnych, rozmiar nowotworu, rodzaj komórek (histologia), zakres przerzutów (poziom rozwoju) oraz przerzuty do wielu węzłów chłonnych i inwazja naczyniowa. Dla osób, u których nie można przeprowadzić operacji, rokowania są gorsze niż u tych z obniżoną sprawnością fizyczną oraz tracących ponad 10% masy ciała. [102] Czynniki wpływające na prognozę w przypadku drobnokomórkowego raka płuc obejmują sprawność fizyczną, płeć, poziom rozwoju choroby oraz udział ośrodkowego układu nerwowego lub wątroby w czasie diagnozy.[103]
W przypadku NSCLC najlepsze rokowanie jest rezultatem całkowitej chirurgicznej resekcji choroby na poziomie IA i zapewnia odsetek przeżywalności na poziomie 70% przez okres pięciu lat.[104] W przypadku SCLC ogólna przeżywalność przez okres pięciu lat wynosi 5%.[1] Przeżywalność osób cierpiących na zaawansowaną formę SCLC przez okres pięciu lat wynosi mniej niż 1%. Przeciętny okres przeżywalności przy ograniczonej formie choroby wynosi 20 miesięcy, a przeżywalność przez okres pięciu lat wynosi 20%.[2]
Według danych przedstawionych przez National Cancer Institute, przeciętny wiek w czasie postawienia diagnozy raka płuc w Stanach Zjednoczonych to 70 lat,[105] podczas gdy przeciętny wiek w czasie zgonu to 72 lata.[106] W USA osoby posiadające ubezpieczenie zdrowotne mają lepsze rokowania.[107]
Epidemiologia
[edytuj | edytuj kod]
no data
≤ 5
5-10
10-15
15-20
20-25
25-30
Szablon:Multicol-break30-35
35-40
40-45
45-50
50-55
≥ 55
Szablon:Multicol-end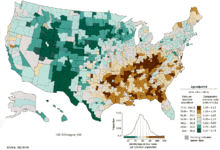
Na całym świecie rak płuc jest naczęściej występującym rakiem pod względem zapadalności oraz śmiertelności. W 2008 r. stwierdzono 1,61 miliona nowych przypadków oraz 1,38 miliona zgonów na skutek raka płuc. Najwyższy odsetek wystęuje w Europie i Ameryce Północnej.[11] Osoby, u których najczęściej rozwija się rak płuc, to palacze należący do grupy osób w wieku powyżej 50 lat. W odróżnieniu od śmiertelności mężczyzn, która zaczęła spadać ponad 20 lat temu, śmiertelność kobiet wynikająca z raka płuc rośnie od kilku dekad i dopiero niedawno zaczęła się stabilizować.[109] W Stanach Zjednoczonych życiowe ryzyko raka płuc wynosi 8% dla mężczyzn i 6% dla kobiet.[1]
Na każde 3–4 miliony wypalonych papierosów przypada jeden zgon w wyniku raka płuc.[1][110] Koncerny wchodzące w skład tzw. „Big Tobacco” odgrywają istotną rolę w kulturze palaczy.[111] Młode osoby niepalące wystawione na działanie reklam tytoniu częściej zaczynają palić.[112] Waga biernego palenia jest coraz częściej uznawana za czynnik ryzyka wystąpienia raka płuc,[24] co prowadzi do zmian w zakresie przepisów, które mają na celu ochronę osób niepalących przed dymem tytoniowym.[113] Spaliny samochodowe, fabryczne i pochodzące z elektrowni również stanowią potencjalne zagrożenie.[4]
Największą śmiertelność wynikającą z raka płuc wśród mężczyzn stwierdzono w Europe Wschodniej, podczas gdy największą śmiertelność wśród kobiet stwierdzono w Europie Północnej i w Stanach Zjednoczonych. W USA większą zapadalność zauważono wśród czarnych mężczyzn i kobiet.[114] Odsetek zachorowań na raka płuc w krajach rozwijających się jest obecnie niższy.[115] Wraz z rosnącą popularnością palenia w krajach rozwijających się w ciągu najbliższych lat wzrośnie prawdopodobnie również odsetek zapadalności, zwłaszcza w Chinach [116] i Indiach.[117]
Od lat 60. odsetek gruczolakoraka wzrasta w porównaniu z częstotliwością występowania innych rodzajów raka płuc. Jest to częściowo związane z wprowadzeniem filtrów papierosowych. Stosowanie filtrów pozwala usunąć duże cząsteczki z dymu papierosowego, ograniczając tym samym osadzanie się ich w większych drogach oddechowych. Jednak palacz zmuszony jest do mocniejszego zaciągania się w celu wdychania tej samej ilości nikotyny, co wpływa na zwiększone osadzanie się ich w mniejszych drogach oddechowych, gdzie najczęściej rozwija się gruczolakorak.[118] Zapadalność na gruczolakoraka nadal wzrasta.[119]
Historia
[edytuj | edytuj kod]Przed wynalezieniem papierosów rak płuc był chorobą rzadką; aż do 1761 r. nie był nawet uznawany za odrębną chorobę.[120] Różne aspekty raka płuc zostały opisane przed 1810 r.[121] Autopsje przeprowadzane w 1878 r. wykazały, że złośliwy nowotwór płuc stanowił zaledwie 1% wszystkich przypadków zachorowań na raka, ale pod koniec XIX w. stanowił już 10-15%.[122] Liczba opisów przypadków w literaturze medycznej w 1912 r. wynosiła 374,[123] ale ponowna analiza wyników autopsji wykazała zapadalność na raka płuc wzrosła z 0,3% w 1852 r. do 5,66% w 1952.[124] W 1929 r. w Niemczech lekarz Fritz Lickint powiązał ze sobą palenie i raka płuc,[122] czego rezultatem była agresywna kampania antynikotynowa.[125] Badania „British Doctors Study”, których wyniki opublikowano w latach 50., były pierwszym rzetelnym epidemiologicznym dowodem na związek raka płuc i palenia.[126] W rezultacie w 1964 r. naczelny lekarz Stanów Zjednoczonych zalecił osobom palącym rzucenie nałogu.[127]
Związek choroby z radonem został zauważony przez górników pracujących w Rudawach w pobliżu miasta Schneeberg w Saksonii. Od 1470 r. wydobywano tam srebro, a w samych kopalniach występują bogate złoża uranu oraz radu i radonu.[128] U górników w nieproporcjonalnym stopniu rozwijały się choroby płuc rozpoznane w latach 70. XIX w. jako rak płuc.[129] Mimo odkrycia kopalnie nie zostały zamknięte aż do lat 50. XX w. w związku z popytem ZSRR na uran.[128] Radon został uznany za przyczynę raka płuc w latach 60.[130]
Pierwszy udany zabieg pneumonektomii związany z rakiem płuc został przeprowadzony w 1933 r.[131] Paliatywna radioterapia była stosowana od lat 40.[132] Radykalna radioterapia, początkowo stosowana w latach 50., była próbą stosowania większych dawek promieniowania u pacjentów przy stosunkowo wczesnym poziomie rozwoju raka płuc, którzy nie mogli zostać poddani zabiegowemu leczeniu chirurgicznemu.[133] W 1997 r. wprowadzono do użytku udoskonaloną w stosunku do konwencjonalnej radykalnej radioterapii, przyspieszoną radioterapię hiperfrakcjonowaną.[134] W latach 60. początkowe próby leczenia drobnokomórkowego raka resekcją chirurgiczną [135] oraz radykalną radioterapią [136] okazały się nieskuteczne. W latach 70. opracowano skuteczne formy chemioterapii.[137]
Przypisy
[edytuj | edytuj kod]- ↑ a b c d e f g h i j k l m n o p q r s t Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieHarrison - ↑ a b c d Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieMerck - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieThun - ↑ a b c d e f g h Chapter 46. W: Alberg AJ, Samet JM: Murray & Nadel's Textbook of Respiratory Medicine. Wyd. 5th. Saunders Elsevier, 2010. ISBN 978-1-4160-4710-0. (ang.).
- ↑ a b Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieO'Reilly - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF1 - ↑ a b c d e f g h i j k 78: Cancer of the Lung. W: C Lu, Onn A, Vaporciyan AA et al.: Holland-Frei Cancer Medicine. Wyd. 8th. People's Medical Publishing House, 2010. ISBN 978-1-60795-014-1. (ang.).
- ↑ Chapter 31. W: S Chapman, Robinson G, Stradling J, West S: Oxford Handbook of Respiratory Medicine. Wyd. 2nd. Oxford University Press, 2009. ISBN 9-780199-545162. (ang.).
- ↑ a b c d e f Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieCollins - ↑ a b J Ferlay, Shin HR, Bray F et al.. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. „International Journal of Cancer”. 127 (12), s. 2893–2917, December 2010. DOI: 10.1002/ijc.25516. PMID: 21351269. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieHonnorat - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieajcc - ↑ 8. W: KM Brown, Keats JJ, Sekulic A et al.: Holland-Frei Cancer Medicine. Wyd. 8th. People's Medical Publishing House USA, 2010. ISBN 978-1607950141. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF5 - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieHecht - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF6 - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiePeto - ↑ California Environmental Protection Agency. Health effects of exposure to environmental tobacco smoke. California Environmental Protection Agency. „Tobacco Control”. 6 (4), s. 346–353, 1997. DOI: 10.1136/tc.6.4.346. PMID: 9583639. (ang.).
* CDC. State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000. „Morbidity and Mortality Weekly Report”. 50 (49), s. 1101–1106, December 2001. Atlanta, Georgia: CDC. PMID: 11794619. (ang.). - ↑ a b c AJ Alberg, Samet JM. Epidemiology of lung cancer. „Chest”. 132 (S3), s. 29S–55S, September 2007. American College of Chest Physicians. DOI: 10.1378/chest.07-1347. PMID: 17873159. (ang.).
- ↑ MS Jaakkola, Jaakkola JJ. Impact of smoke-free workplace legislation on exposures and health: possibilities for prevention. „European Respiratory Journal”. 28 (2), s. 397–408, August 2006. DOI: 10.1183/09031936.06.00001306. PMID: 16880370. (ang.).
- ↑ DM Parkin. Tobacco—attributable cancer burden in the UK in 2010. „British Journal of Cancer”. 105 (Suppl. 2), s. S6–S13, December 2011. DOI: 10.1038/bjc.2011.475. PMID: 22158323. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieNHMRC - ↑ a b R Taylor, Najafi F, Dobson A. Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent. „International Journal of Epidemiology”. 36 (5), s. 1048–1059, October 2007. DOI: 10.1093/ije/dym158. PMID: 17690135. (ang.).
- ↑ Frequently asked questions about second hand smoke. [w:] World Health Organization [on-line]. [dostęp 25 lipca 2012]. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieSchick - ↑ Schmid K, Kuwert T, Drexler H. Radon in Indoor Spaces: An Underestimated Risk Factor for Lung Cancer in Environmental Medicine. „Dtsch Arztebl Int”. 107 (11), s. 181–6, March 2010. DOI: 10.3238/arztebl.2010.0181. PMID: 20386676. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieEPA radon - ↑ 18.19.3. W: RJO Davies, Lee YCG: Oxford Textbook Medicine. Wyd. 5th. OUP Oxford, 2010. ISBN 978-0199204854. (ang.).
- ↑ H Chen, Goldberg MS, Villeneuve PJ. A systematic review of the relation between long-term exposure to ambient air pollution and chronic diseases. „Reviews on Environmental Health”. 23 (4), s. 243–297, Oct-Dec 2008. PMID: 19235364. (ang.).
- ↑ RW Clapp, Jacobs MM, Loechler EL. Environmental and Occupational Causes of Cancer New Evidence, 2005–2007. „Reviews on Environmental Health”. 23 (1), s. 1–37, Jan-Mar 2008. PMID: 18557596. (ang.).
- ↑ a b WY Lim, Seow, A. Biomass fuels and lung cancer.. „Respirology (Carlton, Vic.)”. 17 (1), s. 20-31, 2012 Jan. PMID: 22008241. (ang.).
- ↑ A Sood. Indoor fuel exposure and the lung in both developing and developed countries: an update.. „Clinics in chest medicine”. 33 (4), s. 649-65, 2012 Dec. PMID: 23153607. (ang.).
- ↑ Joel Dudley: Exploring Personal Genomics. Oxford University Press, 2013, s. 25. ISBN 978-0-19-964448-3. (ang.).
- ↑ Kern JA, McLennan G: Fishman's Pulmonary Diseases and Disorders. Wyd. 4th. McGraw-Hill, 2008, s. 1802. ISBN 0-07-145739-9. (ang.).
- ↑ VJ Cogliano, Baan, R; Straif, K; Grosse, Y; Lauby-Secretan, B; El Ghissassi, F; Bouvard, V; Benbrahim-Tallaa, L; Guha, N; Freeman, C; Galichet, L; Wild, CP. Preventable exposures associated with human cancers.. „Journal of the National Cancer Institute”. 103 (24), s. 1827-39, 2011 Dec 21. PMID: 22158127. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieFong - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieSalgia - ↑ a b c d Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieNEJM-molecular - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAviel-Ronen - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieDevereux - ↑ WT Miller: Fishman's Pulmonary Diseases and Disorders. Wyd. 4th. McGraw-Hill, 2008, s. 486. ISBN 0-07-145739-9. (ang.).
- ↑ LR Kaiser: Fishman's Pulmonary Diseases and Disorders. Wyd. 4th. McGraw-Hill, 2008, s. 1815–1816. ISBN 0-07-145739-9. (ang.).
- ↑ a b A Maitra, Kumar V: Robbins Basic Pathology. Wyd. 8th. Saunders Elsevier, 2007, s. 528–529. ISBN 978-1-4160-2973-1. (ang.).
- ↑ J Subramanian, Govindan R. Lung cancer in never smokers: a review. „Journal of Clinical Oncology”. 25 (5), s. 561–570, February 2007. American Society of Clinical Oncology. DOI: 10.1200/JCO.2006.06.8015. PMID: 17290066. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieRaz - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieRosti - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieSeo - ↑ Tan D, Zander DS. Immunohistochemistry for Assessment of Pulmonary and Pleural Neoplasms: A Review and Update. „Int J Clin Exp Pathol”. 1 (1), s. 19–31, 2008. PMID: 18784820. (ang.).
- ↑ a b c R Rami-Porta, Crowley JJ, Goldstraw P. The revised TNM staging system for lung cancer. „Annals of Thoracic and Cardiovascular Surgery”. 15 (1), s. 4–9, February 2009. PMID: 19262443. (ang.).
- ↑ GE Goodman. Lung cancer. 1: prevention of lung cancer. „Thorax”. 57 (11), s. 994–999, November 2002. PMID: 12403886. (ang.).
- ↑ A McNabola, Gill LW. The control of environmental tobacco smoke: a policy review. „International Journal of Environmental Research and Public Health”. 6 (2), s. 741–758, February 2009. DOI: 10.3390/ijerph6020741. PMID: 19440413. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieBhutan - ↑ G Pandey: Indian ban on smoking in public. BBC, 2 października 2008. [dostęp 2012-04-25]. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF10 - ↑ a b c P Fabricius, Lange P. Diet and lung cancer. „Monaldi Archives for Chest Disease”. 59 (3), s. 207–211, July–September 2003. PMID: 15065316. (ang.).
- ↑ H Fritz, Kennedy D, Fergusson D et al.. Vitamin A and Retinoid Derivatives for Lung Cancer: A Systematic Review and Meta Analysis. „PLoS ONE”. 6 (6), 2011. DOI: 10.1371/journal.pone.0021107. PMID: 21738614. (ang.).
- ↑ C Herr, Greulich T, Koczulla RA et al.. The role of vitamin D in pulmonary disease: COPD, asthma, infection, and cancer. „Respiratory Research”. 12 (1), March 2011. DOI: 10.1186/1465-9921-12-31. PMID: 21418564. (ang.).
- ↑ a b TJ Key. Fruit and vegetables and cancer risk. „British Journal of Cancer”. 104 (1), s. 6–11, January 2011. DOI: 10.1038/sj.bjc.6606032. PMID: 21119663. (ang.).
- ↑ RL Manser, Irving LB, Stone C et al.. Screening for lung cancer. „Cochrane Database of Systematic Reviews”, s. CD001991, 2004. DOI: 10.1002/14651858.CD001991.pub2. PMID: 14973979. (ang.).
- ↑ MT Jaklitsch, Jacobson FL, Austin JH et al.. The American Association for Thoracic Surgery guidelines for lung cancer screening using low-dose computed tomography scans for lung cancer survivors and other high-risk groups. „Journal of Thoracic and Cardiovascular Surgery”. 144 (1), s. 33–38, July 2012. DOI: 10.1016/j.jtcvs.2012.05.060. PMID: 22710039. (ang.).
- ↑ PB Bach, Mirkin JN, Oliver TK et al.. Benefits and harms of CT screening for lung cancer: a systematic review. „JAMA: the Journal of the American Medical Association”. 307 (22), s. 2418–2429, June 2012. DOI: 10.1001/jama.2012.5521. PMID: 22610500. (ang.).
- ↑ PM Boiselle. Computed tomography screening for lung cancer.. „JAMA : the journal of the American Medical Association”. 309 (11), s. 1163-70, 2013 Mar 20. PMID: 23512063. (ang.).
- ↑ Bach PB, Mirkin JN, Oliver TK, et al.. Benefits and harms of CT screening for lung cancer: a systematic review. „JAMA”. 307 (22), s. 2418–29, June 2012. DOI: 10.1001/jama.2012.5521. PMID: 22610500. (ang.).
- ↑ DR Aberle, Abtin, F; Brown, K. Computed tomography screening for lung cancer: has it finally arrived? Implications of the national lung screening trial.. „Journal of clinical oncology : official journal of the American Society of Clinical Oncology”. 31 (8), s. 1002-8, 2013 Mar 10. PMID: 23401434. (ang.).
- ↑ B Ferrell, Koczywas M, Grannis F, Harrington A. Palliative care in lung cancer. „Surgical Clinics of North America”. 91 (2), s. 403–417, April 2011. DOI: 10.1016/j.suc.2010.12.003. PMID: 21419260. (ang.).
- ↑ Kaiser LR: Fishman's Pulmonary Diseases and Disorders. Wyd. 4th. McGraw-Hill, 2008, s. 1853–1854. ISBN 0-07-145739-9. (ang.).
- ↑ a b Kaiser LR: Fishman's Pulmonary Diseases and Disorders. Wyd. 4th. McGraw-Hill, 2008, s. 1855–1856. ISBN 0-07-145739-9. (ang.).
- ↑ DD Odell, Kent MS, Fernando HC. Sublobar resection with brachytherapy mesh for stage I non-small cell lung cancer. „Seminars in Thoracic and Cardiovascular Surgery”. 22 (1), s. 32–37, Spring 2010. DOI: 10.1053/j.semtcvs.2010.04.003. PMID: 20813314. (ang.).
- ↑ N Alam, Flores RM. Video-assisted thoracic surgery (VATS) lobectomy: the evidence base. „Journal of the Society of Laparoendoscopic Surgeons”. 11 (3), s. 368–374, July–September 2007. PMID: 17931521. (ang.).
- ↑ NM Rueth, Andrade RS. Is VATS lobectomy better: perioperatively, biologically and oncologically?. „Annals of Thoracic Surgery”. 89 (6), s. S2107–S2111, June 2010. DOI: 10.1016/j.athoracsur.2010.03.020. PMID: 20493991. (ang.).
- ↑ Simon GR, Turrisi A. Management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). „Chest”. 132 (3 Suppl), s. 324S–339S, September 2007. DOI: 10.1378/chest.07-1385. PMID: 17873178. (ang.).
- ↑ SD Goldstein, Yang SC. Role of surgery in small cell lung cancer. „Surgical Oncology Clinics of North America”. 20 (4), s. 769–777, October 2011. DOI: 10.1016/j.soc.2011.08.001. PMID: 21986271. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieOTO - ↑ MQ Hatton, Martin JE. Continuous hyperfractionated accelerated radiotherapy (CHART) and non-conventionally fractionated radiotherapy in the treatment of non-small cell lung cancer: a review and consideration of future directions. „Clinical Oncology (Royal College of Radiologists)”. 22 (5), s. 356–364, June 2010. DOI: 10.1016/j.clon.2010.03.010. PMID: 20399629. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiePORT Meta-analysis Trialists Group - ↑ C Le Péchoux. Role of postoperative radiotherapy in resected non-small cell lung cancer: a reassessment based on new data. „Oncologist”. 16 (5), s. 672–681, 2011. DOI: 10.1634/theoncologist.2010-0150. PMID: 21378080. (ang.).
- ↑ AF Cardona, Reveiz L, Ospina EG et al.. Palliative endobronchial brachytherapy for non-small cell lung cancer. „Cochrane Database of Systematic Reviews”, s. CD004284, April 2008. DOI: 10.1002/14651858.CD004284.pub2. PMID: 18425900. (ang.).
- ↑ H Ikushima. Radiation therapy: state of the art and the future. „Journal of Medical Investigation”. 57 (1–2), s. 1–11, February 2010. PMID: 20299738. (ang.).
- ↑ A Paumier, Cuenca X, Le Péchoux C. Prophylactic cranial irradiation in lung cancer. „Cancer Treatment Reviews”. 37 (4), s. 261–265, June 2011. DOI: 10.1016/j.ctrv.2010.08.009. PMID: 20934256. (ang.).
- ↑ N Girard, Mornex F. Stereotactic radiotherapy for non-small cell lung cancer: From concept to clinical reality. 2011 update. „Cancer Radiothérapie”. 15 (6–7), s. 522–526, October 2011. DOI: 10.1016/j.canrad.2011.07.241. PMID: 21889901. (ang.).
- ↑ A Fairchild, Harris K, Barnes E et al.. Palliative thoracic radiotherapy for lung cancer: a systematic review. „Journal of Clinical Oncology”. 26 (24), s. 4001–4011, August 2008. DOI: 10.1200/JCO.2007.15.3312. PMID: 18711191. (ang.).
- ↑ Hann CL, Rudin CM. Management of small-cell lung cancer: incremental changes but hope for the future. „Oncology (Williston Park)”. 22 (13), s. 1486–92, 2008-11-30. PMID: 19133604. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieMurray - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAzim - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieMacCallum - ↑ a b NSCLC Meta-Analyses Collaborative Group. Chemotherapy in Addition to Supportive Care Improves Survival in Advanced Non–Small-Cell Lung Cancer: A Systematic Review and Meta-Analysis of Individual Patient Data From 16 Randomized Controlled Trials. „J. Clin. Oncol.”. 26 (28), s. 4617–25, October 2008. DOI: 10.1200/JCO.2008.17.7162. PMID: 18678835. (ang.).
- ↑ Mehra R, Treat J: Fishman's Pulmonary Diseases and Disorders. Wyd. 4th. McGraw-Hill, 2008, s. 1876. ISBN 0-07-145739-9. (ang.).
- ↑ a b Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieClegg - ↑ Fuld AD, Dragnev KH, Rigas JR. Pemetrexed in advanced non-small-cell lung cancer. „Expert Opin Pharmacother”. 11 (8), s. 1387–402, June 2010. DOI: 10.1517/14656566.2010.482560. PMID: 20446853. (ang.).
- ↑ DP Carbone, Felip E. Adjuvant therapy in non-small cell lung cancer: future treatment prospects and paradigms. „Clinical Lung Cancer”. 12 (5), s. 261–271, September 2011. DOI: 10.1016/j.cllc.2011.06.002. PMID: 21831720. (ang.).
- ↑ a b T Le Chevalier. Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going?. „Annals of Oncology”. 21 (Suppl. 7), s. vii196–198, October 2010. DOI: 10.1093/annonc/mdq376. PMID: 20943614. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieHorn - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieWakelee - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieClinical evidence - ↑ Kelley AS, Meier DE. Palliative care—a shifting paradigm. „New England Journal of Medicine”. 363 (8), s. 781–2, August 2010. DOI: 10.1056/NEJMe1004139. PMID: 20818881. (ang.).
- ↑ a b Prince-Paul M. When hospice is the best option: an opportunity to redefine goals. „Oncology (Williston Park, N.Y.)”. 23 (4 Suppl Nurse Ed), s. 13–7, April 2009. PMID: 19856592. (ang.).
- ↑ Souquet PJ, Chauvin F, Boissel JP, Bernard JP. Meta-analysis of randomised trials of systemic chemotherapy versus supportive treatment in non-resectable non-small cell lung cancer. „Lung Cancer”. 12 Suppl 1, s. S147–54, April 1995. DOI: 10.1016/0169-5002(95)00430-9. PMID: 7551923. (ang.).
- ↑ Sörenson S, Glimelius B, Nygren P. A systematic overview of chemotherapy effects in non-small cell lung cancer. „Acta Oncol”. 40 (2–3), s. 327–39, 2001. PMID: 11441939. (ang.).
- ↑ Clegg A, Scott DA, Sidhu M, Hewitson P, Waugh N. A rapid and systematic review of the clinical effectiveness and cost-effectiveness of paclitaxel, docetaxel, gemcitabine and vinorelbine in non-small-cell lung cancer. „Health Technol Assess”. 5 (32), s. 1–195, 2001. PMID: 12065068. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiepmid20464750 - ↑ Non-Small Cell Lung Cancer Treatment. [w:] PDQ for Health Professionals [on-line]. National Cancer Institute. [dostęp 2008-11-22]. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF18 - ↑ 18.19.1. W: SG Spiro: Oxford Textbook Medicine. Wyd. 5th. OUP Oxford, 2010. ISBN 978-0199204854. (ang.).
- ↑ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Diagnosis 2002-2003
- ↑ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Death 2002-2006
- ↑ CG Slatore, Au DH, Gould MK. An official American Thoracic Society systematic review: insurance status and disparities in lung cancer practices and outcomes. „American Journal of Respiratory and Critical Care Medicine”. 182 (9), s. 1195–1205, November 2010. DOI: 10.1164/rccm.2009-038ST. PMID: 21041563. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF20 - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF22 - ↑ RN Proctor. The history of the discovery of the cigarette-lung cancer link: evidentiary traditions, corporate denial, global toll. „Tobacco Control”. 21 (2), s. 87–91, March 2012. DOI: 10.1136/tobaccocontrol-2011-050338. PMID: 22345227. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieLum - ↑ C Lovato, Watts A, Stead LF. Impact of tobacco advertising and promotion on increasing adolescent smoking behaviours. „Cochrane Database of Systematic Reviews”, s. CD003439, October 2011. DOI: 10.1002/14651858.CD003439.pub2. PMID: 21975739. (ang.).
- ↑ FB Kemp. Smoke free policies in Europe. An overview. „Pneumologia”. 58 (3), s. 155–158, Jul–Sep 2009. PMID: 19817310. (ang.).
- ↑ National Cancer Institute; SEER stat fact sheets: Lung and Bronchus. Surveillance Epidemiology and End Results. 2010[1]
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF23 - ↑ J Zhang, Ou JX, Bai CX. Tobacco smoking in China: prevalence, disease burden, challenges and future strategies. „Respirology”. 16 (8), s. 1165–1172, November 2011. DOI: 10.1111/j.1440-1843.2011.02062.x. PMID: 21910781. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF25 - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieCharloux - ↑ H Kadara, Kabbout M, Wistuba II. Pulmonary adenocarcinoma: a renewed entity in 2011. „Respirology”. 17 (1), s. 50–65, January 2012. DOI: 10.1111/j.1440-1843.2011.02095.x. PMID: 22040022. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF27 - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF28 - ↑ a b Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieWitschi - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF29 - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieGrannis - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieProctor - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieDoll - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF30 - ↑ a b Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieGreaves - ↑ M Greenberg, Selikoff IJ. Lung cancer in the Schneeberg mines: a reappraisal of the data reported by Harting and Hesse in 1879. „Annals of Occupational Hygiene”. 37 (1), s. 5–14, February 1993. PMID: 8460878. (ang.).
- ↑ JM Samet. Radiation and cancer risk: a continuing challenge for epidemiologists. „Environmental Health”. 10 (Suppl. 1), s. S4, April 2011. DOI: 10.1186/1476-069X-10-S1-S4. PMID: 21489214. (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF32 - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieEdwards - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF33 - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieSaunders - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF34 - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF35 - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieAUTOREF36
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
