Termodynamikk
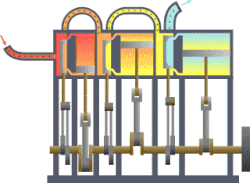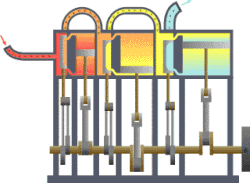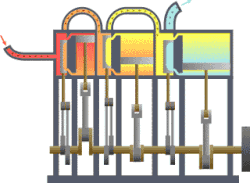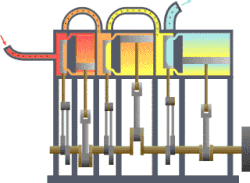
Termodynamikk er den del av fysikken som beskriver hvordan varme og arbeid er forbundet ved at de er forskjellige former av energi. Den anvendes på makroskopiske system som består av et stort antall atomer eller molekyler. Det kan befinne seg i forskjellige tilstander når det er i termisk likevekt. Hver tilstand er karakterisert ved noen få «termodynamiske variable» som kan være trykk, volum, temperatur, magnetisering eller andre, passende størrelser. De er forbundet med hverandre i en tilstandsligning. En «termodynamisk prosess» er en overgang mellom to slike tilstander der noen av de variable tar nye verdier.
Klassisk termodynamikk er basert på noen få og enkle postulat. Første hovedsetning uttrykker hvordan energi er bevart når den omsettes fra varme til andre former, mens andre hovedsetning setter restriksjoner på hvordan denne omformingen kan foregå. Disse lovene er uavhengig av hva det termodynamiske systemet består av og gjelder for så vidt forskjellige innretninger som for eksempel dampmaskiner, kjøleskap, elektromagnetisk stråling og sorte hull.
Ved etableringen av statistisk mekanikk fikk termodynamikken et mer fundementalt grunnlagt. Det var opprinnelig basert på klassisk mekanikk som kunne beskrive bevegelsen til hver enkelt partikkel i systemet når kreftene mellom dem er kjent. Men det var først ved etableringen av kvantemekanikken at dette grunnlaget ble komplett og spesielt avgjørende for innholdet av den andre hovedsetningen.
Selv om termodynamikken har sin opprinnelse i fysikken og fremdeles har en sentral rolle der, ble det også snart klart at den er av stor betydning innen kjemien. Der styrer den forløpet av kjemiske reaksjoner og egenskaper til faste og flytende stoffer som en del av kjemisk termodynamikk. Tilsvarende anvendelser gjøres i dag for biologiske prosesser her på Jorden og nyttes på lignende vis for astrofysiske prosesser i Verdensrommet.
Grunnlag
[rediger | rediger kilde]
På slutten av 1700-tallet definerte Joseph Black ved Universitetet i Glasgow egenskapene varmekapasitet og latent varme ved forskjellige stoffer som oppvarmes. De har fremdeles grunnleggende betydning i moderne termodynamikk. På samme sted arbeidet James Watt med å forbedre dampmaskinen ved å gi den en teknisk utforming som utnyttet varmen i større grad. Dette var også motivasjonen til Sadi Carnot som viste i sitt verk Réflexions sur la puissance motrice du feu fra 1824 at for en maskin som arbeider mellom to gitte temperaturer, finnes det en øvre grense på hvor effektiv den kan være. Selv om denne konklusjonen først vakte liten oppmerksomhet, fikk den senere så stor betydning at Carnot av mange ble utropt til termodynamikkens grunnlegger.[1]
Betraktningene til Carnot ble først kjent gjennom verket Mémoire sur la puissance motrice de la chaleur som Émile Clapeyron publiserte i 1834. Mens Carnot hadde kommet frem til sine konklusjoner med bruk av lite matematikk, viste Clapeyron her hvordan matematisk analyse kan benyttes til å beskrive de forskjellige prosessene. Han presenterte også her den fullstendige tilstandsligningen for en ideell gass med den universelle gasskonstanten R. Men denne teoretiske fremgangen var fremdeles basert på antagelsen at varme er en egen substans med navnet kalorikk som kan overføres fra et stoff til et annet. Desto mer kalorikk som er til stede, desto varmere er stoffet. Det var videre antatt at i slike prosesser ville ingen kalorikk forsvinne, den vil bare ha flyttet seg fra et sted til et annet.
Benjamin Thompson (grev Rumford) hadde allerede flere år tidligere argumentert for at varme må skyldes bevegelse og kan forbindes med mekanisk arbeid. Etter mer systematiske undersøkelser kom Robert Mayer frem til det samme resultat i 1842. Han fant til og med den første verdien 3.58 J/cal for den mekaniske varmeekvivalenten. En nøyaktigere verdi 4.15 J/cal ble funnet noen få år senere av James Joule. Begge disse to var overbeviste om at varme og arbeid kun er to former av energi som er bevart når den ene går over til den andre. Energi kom dermed til å spille en lignende rolle som kalorikk tidligere hadde hatt. Joule bekreftet at dette gjelder også for andre energiformer som for eksempel ved elektrisk oppvarming av vann.[2]
Absolutt temperatur
[rediger | rediger kilde]
Den unge William Thomson (senere Lord Kelvin) ble kjent med Carnots teoretiske resultat gjennom arbeidet til Clayperon. Han innså med en gang deres betydning og kunne allerede i 1848 lansere en ny temperaturskala basert på dem. Dette var den absolutte temperatur T som er uavhengig av egenskapene til materialet i et termometer. Den har en sentral rolle i beskrivelsen av alle termodynamiske prosesser. Den maksimale virkningsgrad til en varmekraftmaskin som arbeider mellom temperaturene T1 og T2 > T1 er da
Et tilsvarende resultatet gjelder for den reverserte prosessen der maskinen virker som en varmepumpe.[3]
Thomson fattet interesse for de eksperimentelle undersøkelsene til Joule hvordan varme kan omsettes til arbeid og omvendt. Sammen kom de frem til flere grunnleggende resultat som Thomson fra 1852 publiserte i flere artikler under navnet On the Dynamical Theory of Heat. Han benyttet her navnet termodynamikk for denne nye varmelæren og ga de første formuleringene av den første og andre hovedsetningen for sammenhengen mellom arbeid og varme. Teorien ble kalt dynamisk fordi varme ikke lenger var en bevart substans, men kunne forklares som bevegelse av materiens minste bestanddeler.
Innholdet av den første hovedsetningen er å betrakte som et uttrykk for prinsippet om energiens bevarelse. Dette var allerede klarlagt av Hermann von Helmholtz og Rudolf Clausius. Den andre hovedsetningen kan formuleres på flere vis og tilsvarer at varme ikke av seg selv kan gå fra lavere til høyere temperatur.[1]
Entropi
[rediger | rediger kilde]Første hovedsetning om energiens bevarelse kan formuleres på mange ulike måter. I termodynamikken omhandler den sammenhengen mellom det arbeid ΔW som en maskin kan utføre når den blir tilført en varmemengde ΔQ . Differansen
utgjør da forandringen i systemets indre energi U. Mens tilført varme nesten alltid regnes som en positiv størrelse, er ofte utført arbeid definert med motsatt fortegn av hva som benyttes her.[4]

Andre hovedsetning ble også gitt en matematisk utforming av Clausius da han i 1865 definerte entropien S til et termodynamisk system.[5] Hvis det blir tilført en varmemengde ΔQ ved temperaturen T, øker dets entropi med ΔS som må oppfylle
Dette er Calusius' ulikhet og inneholder loven om entropiens vekst. Bare når denne forandringen skjer på en reversibel måte, blir dette en likhet.
En syklisk maskin som mottar en varmemengde Q2 ved en temperatur T2 og avgir en mindre mengde Q1 ved T1, vil gjennomgå en entropiforandring som derfor er
når dette skjer reversibelt. For at ΔS = 0, må derfor Q2/T2 = Q1/T1. Da det utførte arbeidet er W = Q2 - Q1, tar dermed virkningsgraden η = W/Q2 sin maksimalverdi ηmax = 1 - T1/T2. Den kan kun oppnås i sykliske maskiner som arbeider fullstendig reversibelt og derfor uten entropiforandring.
For et system som gjennomgår en infinitesemal forandring ved at det utfører for eksempel et mekanisk arbeid ved at dets volum V utvider seg litt mot et eksternt trykk P, kan den matematiske utformingen av andre hovedsetning nå kombineres med den første på differensiell form til å gi
Vanligvis blir denne fundamentale sammenhengen omtalt som «den termodynamiske identitet».[6]
Termodynamikkens lover
[rediger | rediger kilde]Clausius avsluttet sitt verk av 1865 med følgende oppsummering av termodynamikkens to hovedsetninger:
I tillegg blir noen ganger antagelsen at når to systemer er i termisk likevekt med et tredje system, så er de også i likevekt seg imellom, omtalt som «termodynamikkens nullte lov». En tredje lov om at entropien må gå mot null når temperaturen går mot null, ble unødvendig etter at Ludwig Boltzmann hadde gitt den en mer fundamental definisjon basert på statistisk mekanikk.[4]
Termodynamiske størrelser
[rediger | rediger kilde]Tilstandsligninger
[rediger | rediger kilde]Et termodynamisk system kan beskrives av en eller flere tilstandsligninger. De er matematiske relasjoner som systemet alltid vil oppfylle når det er i likevekt. For eksempel gjelder for en ideell gass ved konstant temperatur at trykket og volumet er omvendt proporsjonale, PV = konstant. Dersom systemet har flere variabler, er disse bestemt av andre tilstandsligninger.
Ekstensive og intensive størrelser
[rediger | rediger kilde]Man skiller mellom intensive og ekstensive størrelser. De intensive størrelsene karakteriseres ved at de vil ha samme verdi enten vi ser på hele systemet, eller vi begrenser oss til en del av det. De ekstensive størrelsene vil avhenge av hvor stor del av systemet vi ser på. Anta for eksempel at vi har en gass i likevekt i en beholder, og vil studere bare den ene halvparten av gassvolumet. Trykket i delsystemet vil være det samme som trykket i hele systemet. Massen derimot, som er en ekstensiv størrelse, vil være halvparten av totalmassen.
De to typene opptrer gjerne i par der det for en intensiv størrelse assosieres en tilhørende ekstensiv. Slik relateres for eksempel:
- Trykket P og volumet V
- Temperaturen T og entropien S
- Det kjemiske potensialet μ og stoffmengden N
Det finnes også flere, gjerne knyttet til magnetisme eller elektrisitet.
Slike konjugerte par av størrelser har det til felles at når den ekstensive størrelsen endres, vil den intensive bestemme hvor mye den indre energien til systemet påvirkes. Hvis vi antar at den indre energien U er en funksjon av volum, entropi og stoffmengde, kan en reversibel endring av U = U(S,V,N) skrives
Her er dU endringen i U, og dV, dS og dN endringer av de ekstensive størrelsene V, S og N. Vi ser at P, T og μ avgjør hvor stor innflytelse hver av de ekstensive størrelsene har på dU.
Termodynamiske potensialer
[rediger | rediger kilde]All informasjon om et bestemt system kan sammenfattes ved hjelp av et termodynamisk potensial. Et slikt kalles ofte for en fundamentalrelasjon eller en tilstandsfunksjon, og må ikke forveksles med tilstandsligningene. Kjenner vi det termodynamiske potensialet for et system kan alle tilstandsligningene avledes fra det. Et eksempel på en fundamentalrelasjon er en funksjon for indre energi U(S,V,N), slik som i eksempelet ovenfor.
Vi kan sammenligne uttrykket for dU ovenfor med det totale differensialet av U
- .
Vi ser at følgende relasjoner må gjelde:
Kjenner man funksjonen U = U(S,V,N), kan man herav finne tilstandsligningen for systemet ved å utføre derivasjonene.
Flere termodynamiske potensialer
[rediger | rediger kilde]Ved hjelp av Legendre-transformasjonen kan vi transformere potensialet U(S,V,N) som er en funksjon av ekstensive variable til en funksjon av intensive variable. Den transformerte funksjonen vil ha andre matematiske egenskaper enn U(S,V,N), men vil inneholde samme informasjon som U. Slik kan vi finne andre termodynamiske potensialer som har betydning blant annet innen fysikalsk kjemi:
- Entalpi H(S,P,N) som er praktisk for et system med konstant trykk.
- Helmholtz fri energi F(T,V,N) som er praktisk for et system med konstant temperatur.
- Gibbs fri energi G(T,P,N) som er praktisk for et system under konstant trykk og konstant temperatur. Kan også kalles for fri entalpi.
- Landau fri energi Ω(T,V,μ) som er nyttig for systemer under konstant temperatur og konstant kjemisk potensial. Blir også omtalt som storkanonisk potensial.
Et prinsipielt viktig potensial er entropien S(U,V,N) som kan utledes direkte fra U(S,V,N) uten å bruke Legendre-transformasjonen. Entropien brukes som potensial for isolerte systemer, hvor man direkte kan anvende termodynamikkens andre lov: at isolerte systemer til enhver tid vil søke å maksimere entropien. Dermed kan S(U,V,N) brukes til å finne likevektstilstandene, eller til å se hvilke prosesser systemet spontant vil gjennomgå for å oppnå maksimal entropi.
Hver av tilstandsfunksjonene inneholder like mye informasjon om det termodynamiske systemet. Det er også mulig å transformere motsatt vei og slik gjenvinne U(S,V,N) som vi startet med. Alle potensialene lar oss utlede tilstandsligningene ved partiell derivasjon slik som for U(S,V,N).
Termodynamisk likevekt
[rediger | rediger kilde]Utdypende artikkel: Termodynamisk likevekt
Tilstandsligningene i termodynamikken beskriver systemer i likevekt. Dette er en idealisering fordi reelle prosesser tar tid, og for å oppnå fullstendig likevekt måtte vi ha ventet i det uendelige. Dersom systemet skulle gått gjennom en termodynamisk prosess og hele tiden vært i likevekt, måtte prosessen ha gått uendelig sakte. Et eksempel på dette kan være hvis vi tilfører varme til et egg ved å legge det i et vannbad med høy temperatur. Dersom egget hele tiden hadde vært i termisk likevekt, ville det hatt lik temperatur tvers gjennom. Men vi vet at egget vil først bli varmt ytterst, og så etterhvert innover, ellers ville det vært umulig å bløtkoke et egg.
Hvilken betydning har det at systemene i praksis ikke oppnår likevekt? En konsekvens er at det generelt må utføres mer arbeid for å tilføre systemet energi. Motsatt gjelder det at hvis vi vil hente ut energi fra systemet, får vi mindre igjen for den energien systemet avgir. Begge disse påstandene kan sannsynliggjøres ved å se på kompresjon eller ekspansjon av en gass i en sylinderformet beholder. Vi ser for oss at kompresjonen skjer ved at den ene enden av sylinderen er et stempel som kan beveges. Dersom gassen komprimeres vil trykket først øke ved stempelet, og etterhvert i resten av sylinderen inntil likevekt er oppnådd. Anta at prosessen skjer så raskt at systemet kommer utav likevekt. Det vil si at stempelet må skyves mot et midlertidig trykk som er større enn likevektstrykket. Da vil det kreve mer energi å føre inn stempelet enn hvis systemet var i likevekt. For ekspansjon kan vi gjøre et tilsvarende resonnement.
Reversibilitet
[rediger | rediger kilde]For et generelt system har vi ifølge første lov at endringen av energien i systemet må være summen av tilført varme δQ og annen tilført energi δW,
- .
Dersom vi tilfører energien δW på en måte som tar systemet utav likevekt, og altså bruker mer energi enn nødvendig, ser vi at varmeutvekslingen δQ må bli litt mindre. Det tilsvarer at det er et varmetap til omgivelsene under prosessen.
Hvis vi derimot henter ut energien δW på en måte som tar systemet utav likevekt, vil vi ikke få ut all energien vi kunne fått. Da ser vi at δQ må bli litt større, og det tilsvarer at omgivelsene har et varmetap til systemet under prosessen.
Det varmetapet som skjer på grunn av at systemet er utav likevekt, medfører også at den totale entropien øker. (Total entropi er entropien til systemet og omgivelsene.) Ifølge termodynamikkens andre lov kan entropien til et isolert system bare øke eller være konstant. Det betyr at en prosess der systemet kommer utav likevekt, bare kan skje i den retningen som gjør at den totale entropien øker. Prosessen er irreversibel. I praksis er det umulig å finne en helt reversibel prosess fordi ingen reelle systemer kan være i perfekt likevekt, og det vil følgelig alltid være en viss økning av den totale entropien.
Referanser
[rediger | rediger kilde]- ^ a b G. Holton and S.G. Brush, Physics, the Human Adventure, Rutgers University Press, New Jersey (2006). ISBN 0-8135-2908-5.
- ^ E. Hiis Hauge, James Joule – ølbryggeren som etablerte energiloven, Fra Fysikkens Verden, 2, 47 - 49 (2018). Online
- ^ R.P. Feynman, Lectures on Physics, Caltech , California (1965). Online.
- ^ a b P.W. Atkins, Physical Chemistry, Oxford University Press, England (1988). ISBN 0-19-855186-X.
- ^ R. Clausius, Ueber verschiedene für die Anwendung bequeme Formen der Hauptgleichungen der mechanischen Wärmetheorie, Annalen der Physik 125 (7), 353–400 (1865). Online.
- ^ F.W. Sears, An Introduction to Therrmodynamics, the Kinetic Theory of Gases and Statistical Mechanics, Addison-Wesley Publishing Company, Reading MA (1956).
Opprinnelig litteratur
[rediger | rediger kilde]- S. Carnot, Réflexions sur la Puissance Motrice du Feu, Chez Bachelier, Paris (1824). Original
- S. Carnot, Reflections on the Motive Power of Heat. John Wiley & Sons, New York (1897). Engelsk versjon med kommentarer av William Thomson.
- E. Clapeyron, Meḿoire sur la Puissance Motrice de la Chaleur, Journal de l'École Polytechnique 14, 153–190 (1834).
- R. Clausius, Ueber verschiedene für die Anwendung bequeme Formen der Hauptgleichungen der mechanischen Wärmetheorie, Annalen der Physik, 125 (7), 353–400 (1865).
- R. Clausius, The Mechanical Equivalent of Heat, MacMillan and Co, London (1879). Pedagogisk fremstilling av hans viktigste bidrag. Kan fremdeles benyttes som lærebok i termodynamikk.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.











