ბუფერული ხსნარები
ბუფერული ხსნარები
წყალი სუსტი ელექტროლიტია და უმნიშვნელოდ დისოცირდება: H2 - H + OH სუფთა წყალში 25°C - ზე [H] და [OH] ერთნაირია და ტოლია 10 -7 - ის.
ორგანიზმის PH - ის შენარჩუნება ხორციელდება ბუფერული ხსნარების დახმარებით. ბუფერული ეწოდება ხსნარს, რომელსაც შესწევს უნარი, შეინარჩუნოს წყალბადიონთა კონცერტრაციის მუდმივობა. გარკვეული რაოდენობის ძლიერი მჟავის ან ძლიერი ტუტის დამატებისას. რაოდენობრივად ბუფერულ სისტემებს ახასიათებენ ბუფერული ტევადობით, რომელიც ტოლია ძლიერი მჟავის ან ძლიერი ფუძის ექვივალენტების რაოდენობისა, რომელიც უნდა დაემატოს ერთ ლიტრ ბუფერულ ხსნარს, რათა მისი PH ერთი ერთეულით შეიცვალოს. R = db/dpH სადაც b - ძლიერი მჟავას ან ძლიერი ტუტის რაოდენობაა გრამ-ექვივალენტებში.
ბუფერული ტევადობა მაქსიმალურია ბუფერული სისტემის შემადგენელი კომპონენტების კონცენტრავიის ტოლობისას. მდგრადი PH ხსნარების მომზადების მიზნით მომართავენ ეგრეთ წოდებულ ბუფერულ ხსნარებს. რომელთაც აქვთ უნარი, შეინარჩუნონ PH - ის მუდმივობა განზავებისა ან მჟავის და ფუძის დამატებისას.
ბუფერულ ხსნარებს მიეკუთვნება: 1. ხსნარი რომელიც შედგება სუსტი მჟავასა და ამ სუსტი მჟავას და ძლიერი ტუტის მარილისაგან. 2. ხსნარი, რომელიც შედგება სუსტი ფუძისგან და ამ ფუძის და ძლიერი მჟავას მარილისაგან. 3. ხსნარები, რომლებიც შეიცავს მრავალფუძიანი მჟავას მარილებს.
ორგანიზმში ძირითადი ბუფერული სისტემაა - პიდროკარბონატული; მის წილად მოდის სისხლში ბუფერული მოქმედების 50% და მისი საშუალებით ხდება სისხლის PH = 7,4 შენარჩუნება. ორგანიზმში ნახშირმჟავა წარმოიქმნება CO2 - ის ჰიდრატაციით. ეს პროცესი ხორციელდება ფერმენტ კარბოანჰიდრაზას დახმარებით: CO2+H2O→H2CO3 კარბონატული ბუფერული სისტემა წარმოადგენს სუსტ მჟავას - ნახშირმჟავას და მასთან წონასწორობაში მყოფ ჰიდროკარბონატ იონს: H2CO3 - H+ + HCO3 HCO3 - HCO3 - არის H2CO3 - თან შეუღლებული ფუძე. ამ წყვილის ბუფერული მოქმედების მექანიზმი შემდეგში მდგომარეობს: ბუფერულ სისტემაზე ძლიერი მჟავას დამატებისას, ამ უკანასკნელის დისოციაციის შედეგად მიღებული პროტონები ურთიერთქმედებენ ნახშირმჟავას შეუღლებულ ფუძესთან: H+ + HCO3- H2CO3.
მეორე სისტემა - ფოსფორული ბუფერული სისტემა, რომელიც ახასიათებს წონასწორობას ჰიდროფოსფატსა და დიჰიდროფოსფატის იონებს შორის. ორგანიზმში ჰემოგლობინური ბუფერი წარმოადგენს ერითროციტების მთავარ ბუფერულ სისტემას, რომელიც პროტონის დონორის სახით შეიცავს ორ სუსტ მჟავას - ჰემოგლობის და ოქსიჰემოგლობინს, ხოლო პროტონის აქცეპტორის როლს ასრულებს მჟავათა შეუღლებული ფუძეები.
ოქსიჰემოგლობინი უფრო ძლიერი მჟავაა, ვიდრე ჰემოგლობინი: როცა ერითროციტებში ოქსიჰემოგლობინი იონიზებულია 65%-ით, ხოლო ჰემოგლობინი - 10%-ით. ჰემოგლობინთან ჟანგბადის მიერთებისას (ფილტვებში) სისხლის PH მცირდება შედარებით ძლიერი მჟავას წარმოქმნის გამო: მეორე მხრივ, როდესაც ოქსიჰემოგლობინი გადასცემს ჟანგბადს ქსოვილებს. სისხლის PH ისევ იზრდება. უფრო სუსტი მჟავას (ჰემოგლობინის) წარმოქმნის გამო.
მჟავის სიჭარბისას H - იონებს პირველ რიგში დაიკავშირებს ჰემოგლობინის ანიონი, რომელსაც, როგორც შედარებით ძლიერ ფუძეს, გააჩნია პროტონისადმი, მეტი სწრაფვა, ხოლო ჭარბი ტუტის შემთხვევაში უფრო მეტ აქტიურობას ამჟღავნებს ოქსიჰემოგლობინი, ვიდრე ჰომოგლობინი.
მნიშვნელოვანი ბუფერული ნაერთები
| ქიმიური სახელწოდება | სტრუქტურა | pKa 25 °C-ზე |
ტემპ. ეფექტი (K−1)[1] |
მოლური მასა |
|---|---|---|---|---|
| ([ტრის(ჰიდროქსიმეთილ)მეთილამინო]პროპანსულფონ მჟავა) |  |
8.43 | −0.018 | 243.3 |
| (2-(ბის(2-ჰიდროქსიეთილ)ამინო)ძმარმჟავა) |  |
8.35 | −0.018 | 163.2 |
| (ტრის(ჰიდროქსიმეთილ)ამინომეთანი) ან (2-ამინო-2-(ჰიდროქსიმეთილ)პროპან-1,3-დიოლი) |  |
8.07* | −0.028 | 121.14 |
| (3-[N-ტრის(ჰიდროქსიმეთილ)მეთილამინო]-2-ჰიდროქსიპროპანსულფონ მჟავა) | 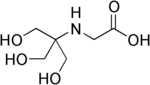 |
8.05 | −0.021 | 179.2 |
| (3-[N-ტრის(ჰიდროქსიმეთილ)მეთილამინო]-2-ჰიდროქსიპროპანსულფონ მჟავა) |  |
7.635 | 259.3 | |
| (4-(2-ჰიდროქსიეთილ)-1-პიპერაზინეთანსულფონ მჟავა) |  |
7.48 | −0.014 | 238.3 |
| (2-[[1,3-დიჰიდროქსი-2-(ჰიდროქსიმეთილ)პროპან-2-ილ]ამინო]ეთანსულფონ მჟავა) |  |
7.40 | −0.020 | 229.20 |
| (3-(N-მორფოლინო)პროპანსულფონ მჟავა) |  |
7.20 | −0.015 | 209.3 |
| (პიპერაზინ-N,N′-ბის(2-ეთანსულფონ მჟავა)) |  |
6.76 | −0.008 | 302.4 |
| (დიმეთილდარიშხანმჟავა) |  |
6.27 | 138.0 | |
| (2-(N-მორფოლინო)ეთანსულფონ მჟავა) |  |
6.15 | −0.011 | 195.2 |
რესურსები ინტერნეტში
სქოლიო
- ↑ Buffer Reference Center. Sigma-Aldrich. დაარქივებულია ორიგინალიდან — 2009-04-17. ციტირების თარიღი: 2009-04-17.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
