ホスホフルクトキナーゼ2
| 6-phosphofructo-2-kinase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 ヒト心臓6-ホスホフルクト-2-キナーゼ二量体 | |||||||||
| 識別子 | |||||||||
| EC番号 | 2.7.1.105 | ||||||||
| CAS登録番号 | 78689-77-7 | ||||||||
| データベース | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB構造 | RCSB PDB PDBj PDBe PDBsum | ||||||||
| 遺伝子オントロジー | AmiGO / QuickGO | ||||||||
| |||||||||
| 6PF2K | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 ヒト肝臓6-ホスホフルクト-2-キナーゼ/フルクトース-2,6-ビスホスファターゼの結晶構造 | |||||||||
| 識別子 | |||||||||
| 略号 | 6PF2K | ||||||||
| Pfam | PF01591 | ||||||||
| Pfam clan | CL0023 | ||||||||
| InterPro | IPR013079 | ||||||||
| PROSITE | PDOC00158 | ||||||||
| SCOP | 1bif | ||||||||
| SUPERFAMILY | 1bif | ||||||||
| |||||||||
| 6-phosphofructo-2-kinase/fructose-bisphosphatase-2 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 PFK2の構造、キナーゼドメイン(シアン)とホスファターゼドメイン(緑)。 | |||||||||||
| 識別子 | |||||||||||
| 略号 | 6PF2K | ||||||||||
| Pfam | PF01591 | ||||||||||
| InterPro | IPR013079 | ||||||||||
| PROSITE | PDOC00158 | ||||||||||
| SCOP | 1bif | ||||||||||
| SUPERFAMILY | 1bif | ||||||||||
| |||||||||||
| fructose-bisphosphatase-2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 識別子 | |||||||||
| 略号 | FBPase-2 | ||||||||
| Pfam | PF00316 | ||||||||
| InterPro | IPR028343 | ||||||||
| PROSITE | PDOC00114 | ||||||||
| |||||||||
ホスホフルクトキナーゼ2(phosphofructokinase 2、6-ホスホフルクト-2-キナーゼ(6-phosphofructo-2-kinase)、略称: PFK-2)またはフルクトースビスホスファターゼ2(fructose bisphosphatase 2、フルクトース-2,6-ビスホスファターゼ(fructose 2,6-bisphosphatase)略称: FBPase-2)は、細胞内の解糖系と糖新生の割合の調節を間接的に担う酵素である。この酵素は、フルクトース-6-リン酸からのフルクトース-2,6-ビスリン酸(Fru-2,6-P2)の形成と分解を触媒する。Fru-2,6-P2は解糖系経路のホスホフルクトキナーゼ1(PFK-1)を活性化して解糖系の律速段階に寄与し、また糖新生経路のフルクトース-1,6-ビスホスファターゼ1を阻害する[1]。Fru-2,6-P2は解糖系と糖新生に対して異なる調節を行うため、これら逆方向の経路の切り替えにおける重要なシグナルとして作用する[1]。PFK-2はホルモンシグナルに応答してFru-2,6-P2を産生するため、代謝は生体の解糖系の需要と協調した形で、より敏感かつ効率的に制御されるようになる[2]。この酵素はフルクトースとマンノースの代謝に関与する。この酵素は肝臓での炭水化物代謝の調節に重要であり、肝臓、腎臓、心臓に最も多く存在する。哺乳類では、いくつかの遺伝子が異なるアイソザイムをコードしており、それぞれ組織分布と酵素の特性が異なる[3]。ここに記載されている酵素ファミリーはATP駆動型のホスホフルクトキナーゼとの類似点が存在し、両者は配列類似性はとんどないものの、フルクトース-6-リン酸との相互作用に重要ないくつかの残基は共通しているようである[4]。
PKF-2は二機能性酵素(bifunctional enzyme)として知られており、双方の活性は同じポリペプチドによって触媒されるが、2つのドメインがそれぞれ独立して機能する酵素として作用する[5]、一方の端(N末端)がキナーゼドメイン(PFK-2)、もう一方の端(C末端)がホスファターゼドメイン(FBPase-2)として作用する[6]。
哺乳類では、組織特異的な需要に応えるため、PFK-2のさまざまなアイソザイムがコードされている。これらは一般的な機能は同一であるが、酵素の性質にはわずかな差異が存在し、異なる調節によって制御されている[7]。
構造
[編集]この二機能性酵素の単量体は、2つの機能的ドメインへと明確に分割される。キナーゼドメインはN末端側に位置し[8]、5本の平行ストランドと末端の1本の逆平行エッジストランドからなるβシートが7本のαヘリックスに囲まれた構造をしている[6]。最初のβストランドのC末端側にはヌクレオチド結合フォールドが位置している[9]。キナーゼドメインは、アデニル酸シクラーゼなどのモノヌクレオチド結合タンパク質スーパーファミリーと密接な関係にあるようである[10]。
一方、ホスファターゼドメインはC末端側に位置する[11]。このドメインはホスホグリセリン酸ムターゼや酸性ホスファターゼなどのタンパク質ファミリーと類似している[10][12]。このドメインは中心部に6本のストランドからなるβシートを持つα/β混合型構造で、加えてαヘリカルサブドメインが活性部位を覆っている[6]。最後に、N末端領域がキナーゼ活性とホスファターゼ活性を調節し、酵素の二量体を安定化している[12][13]。
中心部の触媒コアは全てのPFK-2で保存されているが、アイソフォーム間にはアミノ酸配列の差異や選択的スプライシングによるわずかな構造的多様性が存在する[14]。一部の例外を除いて、PFK-2の典型的なサイズは約55 kDaである[1]。
この酵素の独特な二機能構造は、原始的細菌のPFK-1とムターゼ/ホスファターゼとの遺伝子融合によって生じたものであると考えられている[15]。
機能
[編集]この酵素の主な機能は、細胞や生体の解糖系の需要に応じてアロステリック調節因子Fru-2,6-P2を合成または分解することである。
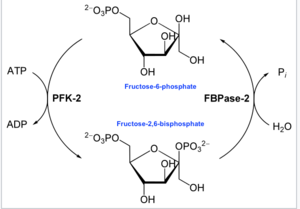
酵素学的には、6-ホスホフルクト-2-キナーゼ(EC 2.7.1.105)は次の化学反応を触媒する酵素である。
- ATP + β-D-フルクトース-6-リン酸 ADP + β-D-フルクトース-2,6-ビスリン酸[16]
すなわち、キナーゼドメインはATPを加水分解してフルクトース-6-リン酸の2位の炭素をリン酸化し、Fru-2,6-P2とADPを生成する。反応時にはリン酸化ヒスチジン中間体が形成される[17]。
また、フルクトース-2,6-ビスリン酸 2-ホスファターゼ(EC 3.1.3.46)ドメインは、Fru-2,6-P2に水を付加して脱リン酸化する。この反応は次の式で表される。
- β-D-フルクトース-2,6-ビスリン酸 + H2O D-フルクトース-6-リン酸 + リン酸[18]
この酵素は2つの機能を持つため、複数のファミリーに分類される。キナーゼ反応に基づく分類では、この酵素は転移酵素のファミリー、具体的にはアルコール基を受容体としてリン含有官能基を転移する酵素(ホスホトランスフェラーゼ)に分類される[16]。一方、ホスファターゼ反応は加水分解酵素のファミリーに特徴的なものであり、具体的にはリン酸モノエステル結合に作用するものに分類される[18]。
調節
[編集]PFK-2のほとんどのアイソフォームは、ホルモンシグナルによってリン酸化/脱リン酸化による共有結合修飾が行われる。特定残基のリン酸化は、キナーゼドメインまたはホスファターゼドメインの機能のいずれかを安定化するような変化を促進する場合がある。この調節は、Fru-2,6-P2が合成されるか分解されるかを制御するシグナルとなる[19]。
さらに、PFK-2はPFK-1の調節と非常に類似したアロステリック調節が行われる[20]。高レベルのAMPやリン酸基の存在はエネルギー状態が低いことを意味し、そのためPFK2が刺激される。一方、高濃度のホスホエノールピルビン酸 (PEP) やクエン酸の存在は生合成前駆体の濃度が高いことを意味し、PFK-2は抑制される。PFK-1とは異なり、PFK-2はATP濃度の影響は受けない[21]。
アイソザイム
[編集]アイソザイムとは、同じ反応を触媒する酵素であるものの、異なるアミノ酸配列でコードされているものであり、そのためタンパク質の特性には差異が存在する。ヒトでは、PFKFB1、PFKFB2、PFKFB3、PFKFB4の4つの遺伝子がPFK-2をコードしている[5]。
これまで哺乳類で複数のアイソザイムが報告されているが、それらの差異は異なる遺伝子の転写や選択的スプライシングによるものである[22][23][24]。PFK-2/FBPase-2反応を触媒する構造的コアはアイソザイム間で高度に保存されている一方で、アイソザイム間の差異はコアのN末端側やC末端側に隣接する多様な配列によるものである[14]。こうした領域にはリン酸化部位の存在や、アミノ酸組成や長さの差異がみられることが多く、酵素の速度論や特性を異なるものにしている[1][14]。各アイソザイムは主な発現組織、プロテインキナーゼによる調節に対する応答、キナーゼ/ホスファターゼドメインの活性の比率が異なる[25]。ある組織に複数のタイプのアイソザイムが存在することもあるが、下ではアイソザイムを主な発現組織と発見された組織によって分類している[26]。
PFKFB1: 肝臓、筋肉、胎児型
[編集]| 6-phosphofructo-2-kinase: PFKFB1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 ヒト肝臓PFK-2/FBPase-2の結晶構造 | |||||||||
| 識別子 | |||||||||
| EC番号 | 2.7.1.105 | ||||||||
| CAS登録番号 | 78689-77-7 | ||||||||
| データベース | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB構造 | RCSB PDB PDBj PDBe PDBsum | ||||||||
| 遺伝子オントロジー | AmiGO / QuickGO | ||||||||
| |||||||||
PFKFB1はX染色体に位置し、最もよく研究されている肝臓型の酵素をコードする遺伝子である[22]。PFKFB1からは、異なるプロモーターによってL型、M型、F型のPFK-2が産生され、これら3つの組織特異的バリアントは異なる調節を受ける[27][28]。
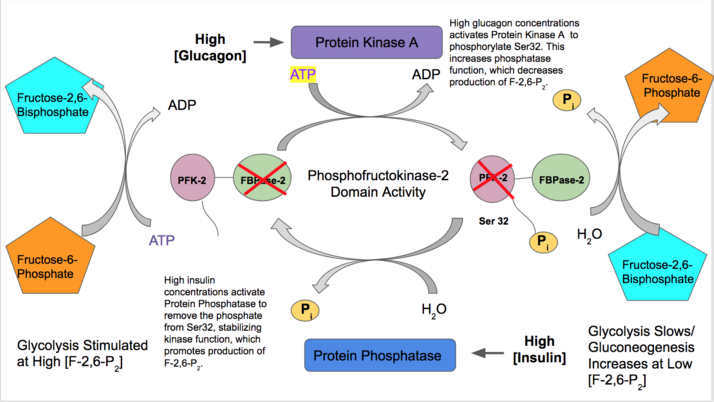
- L型: 肝臓型
- インスリンは肝臓のPFK-2の機能を活性化し、解糖系で利用可能な血中グルコースが豊富に存在することを示す。インスリンはPFK-2を脱リン酸化するプロテインホスファターゼを活性化し、PFK-2活性を優位にする。その結果、PFK-2によるFru-2,6-P2の産生が増加する。この反応産物はPFK-1をアロステリックに活性化するため、解糖系を活性化し糖新生を阻害することとなる[29]。
- 反対に、グルカゴンはFBPase-2活性を増加させる。血糖値が低い場合には、グルカゴンはcAMPシグナル伝達カスケードを開始し、そしてプロテインキナーゼA(PKA)がN末端付近のセリン32番残基をリン酸化する。これによって二機能酵素のキナーゼ作用が不活性化され、ホスファターゼ活性が安定化される。そのため、グルカゴンはFru-2,6-P2の濃度を低下させ、解糖系の割合を低下させて解糖系経路を刺激する[30][31]。
| 6-phosphofructo-2-kinase: PFKFB2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 ヒト心臓6-ホスホフルクト-2-キナーゼ二量体 | |||||||||
| 識別子 | |||||||||
| EC番号 | 2.7.1.105 | ||||||||
| CAS登録番号 | 78689-77-7 | ||||||||
| データベース | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB構造 | RCSB PDB PDBj PDBe PDBsum | ||||||||
| 遺伝子オントロジー | AmiGO / QuickGO | ||||||||
| |||||||||
PFKFB2: 心臓型(H型)
[編集]PFKFB2遺伝子は1番染色体に位置する[33]。多量のアドレナリンまたはインスリンが血液循環している際には、PKA経路が活性化されてC末端に位置するSer466とSer483のいずれかがリン酸化される[3]。代わりに、プロテインキナーゼBがこれらFBPase-2ドメインに位置する調節部位をリン酸化する場合もある[34]。これらのセリン残基がリン酸化されると、FBPase-2機能は不活性化され、PFK-2活性が安定化される[27]。
PFKFB3: 脳、胎盤、誘導型
[編集]PFKFB3遺伝子は10番染色体に位置し、誘導型と遍在型の2つの主要なアイソフォームが転写される[35]。これらはC末端のエクソン15の選択的スプライシングが異なる[36]。しかしながら、どちらもグルカゴンがcAMP経路を活性化し、PKA、プロテインキナーゼCまたはAMP活性化プロテインキナーゼによってC末端のSer461の調節部位がリン酸化され、PFK-2のキナーゼ機能が安定化される点は類似している[37]。さらに、この遺伝子から転写されるどちらのアイソフォームもキナーゼ活性が高く優勢であり、キナーゼ/ホスファターゼ活性比は700である(肝臓、心臓、精巣型アイソザイムはそれぞれ1.5、80、4)[38]。そのため、PFKFB3は常に多量のFru-2,6-P2を産生し、解糖系を高く維持する[38][39]。
PFKFB4: 精巣型(T型)
[編集]PFKFB4遺伝子は3番染色体に位置し、ヒトの精巣組織でPFK-2を発現する[47]。PFKFB4にコードされるPFK-2のサイズは約54 kDaと肝臓型酵素と同程度であり、そして筋組織型の酵素と同様にプロテインキナーゼによるリン酸化部位は存在しない[41]。このアイソフォームの調節機構に関する研究は比較的少ないが、発生中の精巣組織では5'側隣接領域での複数の転写因子による調節によってPFK-2の量が調節されていることが確認されている[26]。このアイソフォームは、前立腺がん細胞の生存のために過剰発現していることが示唆されている[48]。
臨床的意義
[編集]この酵素ファミリーは解糖系と糖新生の割合を維持するため、特に糖尿病やがん細胞における代謝制御による治療効果が期待される[6][25]。酸素の制限によって、PFK-2の遺伝子全て(PFKFB3が最も劇的である)が活性化されることが示されている[49]。PFK-2/FBPase-2活性の制御は、心臓の機能、特に虚血に対する機能や低酸素に対する制御と関係している[50]。こうしたPFK-2遺伝子の応答特性は、強い進化的な生理適応である可能性があると考えられている[49]。一方で、多くのヒトのがん細胞(白血病、肺がん、乳がん、結腸がん、膵臓がん、卵巣がんなど)ではPFKFB3やPFKFB4が過剰発現しており、この代謝の変化はワールブルク効果に関与している可能性が高い[25][51]。
また、PFK-2/FBPase-2タンパク質をコードするPFKFB2遺伝子は、統合失調症の素因と関連づけられている[52]。
出典
[編集]- ^ a b c d Kurland IJ, Pilkis SJ (June 1995). "Covalent control of 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: insights into autoregulation of a bifunctional enzyme". Protein Science. 4 (6): 1023–37. doi:10.1002/pro.5560040601. PMC 2143155. PMID 7549867。
- ^ Lenzen S (May 2014). "A fresh view of glycolysis and glucokinase regulation: history and current status". The Journal of Biological Chemistry. 289 (18): 12189–94. doi:10.1074/jbc.R114.557314. PMC 4007419. PMID 24637025。
- ^ a b Heine-Suñer D, Díaz-Guillén MA, Lange AJ, Rodríguez de Córdoba S (May 1998). "Sequence and structure of the human 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase heart isoform gene (PFKFB2)". European Journal of Biochemistry. 254 (1): 103–10. doi:10.1046/j.1432-1327.1998.2540103.x. PMID 9652401。
- ^ Wang X, Deng Z, Kemp RG (September 1998). "An essential methionine residue involved in substrate binding by phosphofructokinases". Biochem. Biophys. Res. Commun. 250 (2): 466–8. doi:10.1006/bbrc.1998.9311. PMID 9753654。
- ^ a b Rider MH, Bertrand L, Vertommen D, Michels PA, Rousseau GG, Hue L (August 2004). "6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: head-to-head with a bifunctional enzyme that controls glycolysis". The Biochemical Journal. 381 (Pt 3): 561–79. doi:10.1042/BJ20040752. PMC 1133864. PMID 15170386。
- ^ a b c d Hasemann CA, Istvan ES, Uyeda K, Deisenhofer J (September 1996). "The crystal structure of the bifunctional enzyme 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase reveals distinct domain homologies". Structure. 4 (9): 1017–29. doi:10.1016/S0969-2126(96)00109-8. PMID 8805587。
- ^ Atsumi T, Nishio T, Niwa H, Takeuchi J, Bando H, Shimizu C, Yoshioka N, Bucala R, Koike T (December 2005). "Expression of inducible 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase/PFKFB3 isoforms in adipocytes and their potential role in glycolytic regulation". Diabetes. 54 (12): 3349–57. doi:10.2337/diabetes.54.12.3349. PMID 16306349。
- ^ Kurland I, Chapman B, Lee YH, Pilkis S (August 1995). "Evolutionary reengineering of the phosphofructokinase active site: ARG-104 does not stabilize the transition state in 6-phosphofructo-2-kinase". Biochemical and Biophysical Research Communications. 213 (2): 663–72. doi:10.1006/bbrc.1995.2183. PMID 7646523。
- ^ Walker JE, Saraste M, Runswick MJ, Gay NJ (1982). "Distantly related sequences in the alpha- and beta-subunits of ATP synthase, myosin, kinases and other ATP-requiring enzymes and a common nucleotide binding fold". The EMBO Journal. 1 (8): 945–51. doi:10.1002/j.1460-2075.1982.tb01276.x. PMC 553140. PMID 6329717。
- ^ a b Jedrzejas MJ (2000). "Structure, function, and evolution of phosphoglycerate mutases: comparison with fructose-2,6-bisphosphatase, acid phosphatase, and alkaline phosphatase". Progress in Biophysics and Molecular Biology. 73 (2–4): 263–87. doi:10.1016/S0079-6107(00)00007-9. PMID 10958932。
- ^ Li L, Lin K, Pilkis J, Correia JJ, Pilkis SJ (October 1992). "Hepatic 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase. The role of surface loop basic residues in substrate binding to the fructose-2,6-bisphosphatase domain". The Journal of Biological Chemistry. 267 (30): 21588–94. doi:10.1016/S0021-9258(19)36651-7. PMID 1328239。
- ^ a b Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L. (2008). “The Balance Between Glycolysis and Gluconeogenesis in the Liver Is Sensitive to Blood-Glucose Concentration”. Biochemistry (Looseleaf). San Francisco: W. H. Freeman. pp. 466–467. ISBN 978-1-4292-3502-0
- ^ Tominaga N, Minami Y, Sakakibara R, Uyeda K (July 1993). "Significance of the amino terminus of rat testis fructose-6-phosphate, 2-kinase:fructose-2,6-bisphosphatase". The Journal of Biological Chemistry. 268 (21): 15951–7. doi:10.1016/S0021-9258(18)82344-4. PMID 8393455。
- ^ a b c El-Maghrabi MR, Noto F, Wu N, Manes N (September 2001). "6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: suiting structure to need, in a family of tissue-specific enzymes". Current Opinion in Clinical Nutrition and Metabolic Care. 4 (5): 411–8. doi:10.1097/00075197-200109000-00012. PMID 11568503. S2CID 6638455。
- ^ Bazan JF, Fletterick RJ, Pilkis SJ (December 1989). "Evolution of a bifunctional enzyme: 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase". Proceedings of the National Academy of Sciences of the United States of America. 86 (24): 9642–6. Bibcode:1989PNAS...86.9642B. doi:10.1073/pnas.86.24.9642. PMC 298557. PMID 2557623。
- ^ a b “ENZYME entry 2.7.1.105”. enzyme.expasy.org. 2018年3月24日閲覧。
- ^ “6-phosphofructo-2-kinase (IPR013079)”. InterPro. EMBL-EBI. 2018年3月25日閲覧。
- ^ a b “ENZYME entry 3.1.3.46”. enzyme.expasy.org. 2018年3月25日閲覧。
- ^ Okar DA, Manzano A, Navarro-Sabatè A, Riera L, Bartrons R, Lange AJ (January 2001). "PFK-2/FBPase-2: maker and breaker of the essential biofactor fructose-2,6-bisphosphate". Trends in Biochemical Sciences. 26 (1): 30–5. doi:10.1016/S0968-0004(00)01699-6. PMID 11165514。
- ^ Van Schaftingen E, Hers HG (August 1981). "Phosphofructokinase 2: the enzyme that forms fructose 2,6-bisphosphate from fructose 6-phosphate and ATP". Biochemical and Biophysical Research Communications. 101 (3): 1078–84. doi:10.1016/0006-291X(81)91859-3. PMID 6458291。
- ^ a b Ros S, Schulze A (February 2013). "Balancing glycolytic flux: the role of 6-phosphofructo-2-kinase/fructose 2,6-bisphosphatases in cancer metabolism". Cancer & Metabolism. 1 (1): 8. doi:10.1186/2049-3002-1-8. PMC 4178209. PMID 24280138。
- ^ a b Darville MI, Crepin KM, Hue L, Rousseau GG (September 1989). "5' flanking sequence and structure of a gene encoding rat 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase". Proceedings of the National Academy of Sciences of the United States of America. 86 (17): 6543–7. Bibcode:1989PNAS...86.6543D. doi:10.1073/pnas.86.17.6543. PMC 297880. PMID 2549541。
- ^ Tsuchiya Y, Uyeda K (May 1994). "Bovine heart fructose 6-P,2-kinase:fructose 2,6-bisphosphatase mRNA and gene structure". Archives of Biochemistry and Biophysics. 310 (2): 467–74. doi:10.1006/abbi.1994.1194. PMID 8179334。
- ^ Sakata J, Abe Y, Uyeda K (August 1991). "Molecular cloning of the DNA and expression and characterization of rat testes fructose-6-phosphate,2-kinase:fructose-2,6-bisphosphatase". The Journal of Biological Chemistry. 266 (24): 15764–70. doi:10.1016/S0021-9258(18)98475-9. PMID 1651918。
- ^ a b c Novellasdemunt L, Tato I, Navarro-Sabate A, Ruiz-Meana M, Méndez-Lucas A, Perales JC, Garcia-Dorado D, Ventura F, Bartrons R, Rosa JL (April 2013). "Akt-dependent activation of the heart 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase (PFKFB2) isoenzyme by amino acids". The Journal of Biological Chemistry. 288 (15): 10640–51. doi:10.1074/jbc.M113.455998. PMC 3624444. PMID 23457334。
- ^ a b Gómez M, Manzano A, Navarro-Sabaté A, Duran J, Obach M, Perales JC, Bartrons R (January 2005). "Specific expression of pfkfb4 gene in spermatogonia germ cells and analysis of its 5'-flanking region". FEBS Letters. 579 (2): 357–62. doi:10.1016/j.febslet.2004.11.096. PMID 15642344. S2CID 33170865。
- ^ a b c Salway JG (2017). Metabolism at a Glance. Wiley-Blackwell. ISBN 978-0-470-67471-0。
- ^ Ros, Susana; Schulze, Almut (2013-02-04). “Balancing glycolytic flux: the role of 6-phosphofructo-2-kinase/fructose 2,6-bisphosphatases in cancer metabolism”. Cancer & Metabolism 1 (1): 8. doi:10.1186/2049-3002-1-8. ISSN 2049-3002. PMC 4178209. PMID 24280138.
- ^ Hue L, Rider MH, Rousseau GG (1990). "Fructose-2,6-bisphosphate in extra hepatic tissues". In Pilkis SJ (ed.). Fructose-2,6-bisphosphate. Boca Raton, Fla.: CRC Press. pp. 173–193. ISBN 978-0-8493-4795-5。
- ^ Pilkis SJ, el-Maghrabi MR, Claus TH (1988). "Hormonal regulation of hepatic gluconeogenesis and glycolysis". Annual Review of Biochemistry. 57: 755–83. doi:10.1146/annurev.bi.57.070188.003543. PMID 3052289。
- ^ Marker AJ, Colosia AD, Tauler A, Solomon DH, Cayre Y, Lange AJ, el-Maghrabi MR, Pilkis SJ (April 1989). "Glucocorticoid regulation of hepatic 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase gene expression". The Journal of Biological Chemistry. 264 (12): 7000–4. doi:10.1016/S0021-9258(18)83531-1. PMID 2540168。
- ^ Cosin-Roger J, Vernia S, Alvarez MS, Cucarella C, Boscá L, Martin-Sanz P, Fernández-Alvarez AJ, Casado M (February 2013). "Identification of a novel Pfkfb1 mRNA variant in rat fetal liver". Biochemical and Biophysical Research Communications. 431 (1): 36–40. doi:10.1016/j.bbrc.2012.12.109. PMID 23291237。
- ^ Darville MI, Chikri M, Lebeau E, Hue L, Rousseau GG (August 1991). "A rat gene encoding heart 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase". FEBS Letters. 288 (1–2): 91–4. doi:10.1016/0014-5793(91)81009-W. PMID 1652483. S2CID 34116121。
- ^ Marsin AS, Bertrand L, Rider MH, Deprez J, Beauloye C, Vincent MF, Van den Berghe G, Carling D, Hue L (October 2000). "Phosphorylation and activation of heart PFK-2 by AMPK has a role in the stimulation of glycolysis during ischaemia". Current Biology. 10 (20): 1247–55. doi:10.1016/S0960-9822(00)00742-9. PMID 11069105. S2CID 7920767。
- ^ Riera L, Manzano A, Navarro-Sabaté A, Perales JC, Bartrons R (April 2002). "Insulin induces PFKFB3 gene expression in HT29 human colon adenocarcinoma cells". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1589 (2): 89–92. doi:10.1016/S0167-4889(02)00169-6. PMID 12007784。
- ^ Marsin AS, Bouzin C, Bertrand L, Hue L (August 2002). "The stimulation of glycolysis by hypoxia in activated monocytes is mediated by AMP-activated protein kinase and inducible 6-phosphofructo-2-kinase". The Journal of Biological Chemistry. 277 (34): 30778–83. doi:10.1074/jbc.M205213200. PMID 12065600。
- ^ a b c Sakakibara R, Kato M, Okamura N, Nakagawa T, Komada Y, Tominaga N, Shimojo M, Fukasawa M (July 1997). "Characterization of a human placental fructose-6-phosphate, 2-kinase/fructose-2,6-bisphosphatase". Journal of Biochemistry. 122 (1): 122–8. doi:10.1093/oxfordjournals.jbchem.a021719. PMID 9276680。
- ^ Manes NP, El-Maghrabi MR (June 2005). "The kinase activity of human brain 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase is regulated via inhibition by phosphoenolpyruvate". Archives of Biochemistry and Biophysics. 438 (2): 125–36. doi:10.1016/j.abb.2005.04.011. PMID 15896703。
- ^ Chesney J, Mitchell R, Benigni F, Bacher M, Spiegel L, Al-Abed Y, Han JH, Metz C, Bucala R (March 1999). "An inducible gene product for 6-phosphofructo-2-kinase with an AU-rich instability element: role in tumor cell glycolysis and the Warburg effect". Proceedings of the National Academy of Sciences of the United States of America. 96 (6): 3047–52. Bibcode:1999PNAS...96.3047C. doi:10.1073/pnas.96.6.3047. PMC 15892. PMID 10077634。
- ^ a b Manzano A, Rosa JL, Ventura F, Pérez JX, Nadal M, Estivill X, Ambrosio S, Gil J, Bartrons R (1998). "Molecular cloning, expression, and chromosomal localization of a ubiquitously expressed human 6-phosphofructo-2-kinase/ fructose-2, 6-bisphosphatase gene (PFKFB3)". Cytogenetics and Cell Genetics. 83 (3–4): 214–7. doi:10.1159/000015181. PMID 10072580. S2CID 23221556。
- ^ Sakai A, Kato M, Fukasawa M, Ishiguro M, Furuya E, Sakakibara R (March 1996). "Cloning of cDNA encoding for a novel isozyme of fructose 6-phosphate, 2-kinase/fructose 2,6-bisphosphatase from human placenta". Journal of Biochemistry. 119 (3): 506–11. doi:10.1093/oxfordjournals.jbchem.a021270. PMID 8830046。
- ^ Ventura F, Ambrosio S, Bartrons R, el-Maghrabi MR, Lange AJ, Pilkis SJ (April 1995). "Cloning and expression of a catalytic core bovine brain 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase". Biochemical and Biophysical Research Communications. 209 (3): 1140–8. doi:10.1006/bbrc.1995.1616. PMID 7733968。
- ^ Bando H, Atsumi T, Nishio T, Niwa H, Mishima S, Shimizu C, Yoshioka N, Bucala R, Koike T (August 2005). "Phosphorylation of the 6-phosphofructo-2-kinase/fructose 2,6-bisphosphatase/PFKFB3 family of glycolytic regulators in human cancer". Clinical Cancer Research. 11 (16): 5784–92. doi:10.1158/1078-0432.CCR-05-0149. PMID 16115917。
- ^ Riera L, Obach M, Navarro-Sabaté A, Duran J, Perales JC, Viñals F, Rosa JL, Ventura F, Bartrons R (August 2003). "Regulation of ubiquitous 6-phosphofructo-2-kinase by the ubiquitin-proteasome proteolytic pathway during myogenic C2C12 cell differentiation". FEBS Letters. 550 (1–3): 23–9. doi:10.1016/S0014-5793(03)00808-1. PMID 12935880. S2CID 41726316。
- ^ Ventura F, Rosa JL, Ambrosio S, Pilkis SJ, Bartrons R (September 1992). "Bovine brain 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase. Evidence for a neural-specific isozyme". The Journal of Biological Chemistry. 267 (25): 17939–43. doi:10.1016/S0021-9258(19)37133-9. PMID 1325453。
- ^ Manzano A, Pérez JX, Nadal M, Estivill X, Lange A, Bartrons R (March 1999). "Cloning, expression and chromosomal localization of a human testis 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase gene". Gene. 229 (1–2): 83–9. doi:10.1016/S0378-1119(99)00037-2. PMID 10095107。
- ^ Ros S, Santos CR, Moco S, Baenke F, Kelly G, Howell M, Zamboni N, Schulze A (April 2012). "Functional metabolic screen identifies 6-phosphofructo-2-kinase/fructose-2,6-biphosphatase 4 as an important regulator of prostate cancer cell survival". Cancer Discovery. 2 (4): 328–43. doi:10.1158/2159-8290.CD-11-0234. PMID 22576210。
- ^ a b Minchenko, Oleksandr; Opentanova, Iryna; Caro, Jaime (20 November 2003). "Hypoxic regulation of the 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase gene family (PFKFB-1-4) expression in vivo". FEBS letters. 554 (3): 264–270. doi:10.1016/s0014-5793(03)01179-7. ISSN 0014-5793. PMID 14623077。
- ^ Wang Q, Donthi RV, Wang J, Lange AJ, Watson LJ, Jones SP, Epstein PN (June 2008). "Cardiac phosphatase-deficient 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase increases glycolysis, hypertrophy, and myocyte resistance to hypoxia". American Journal of Physiology. Heart and Circulatory Physiology. 294 (6): H2889–97. doi:10.1152/ajpheart.91501.2007. PMC 4239994. PMID 18456722。
- ^ Minchenko OH, Opentanova IL, Ogura T, Minchenko DO, Komisarenko SV, Caro J, Esumi H (2005). "Expression and hypoxia-responsiveness of 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase 4 in mammary gland malignant cell lines". Acta Biochimica Polonica. 52 (4): 881–8. doi:10.18388/abp.2005_3402. PMID 16025159。
- ^ Stone WS, Faraone SV, Su J, Tarbox SI, Van Eerdewegh P, Tsuang MT (May 2004). "Evidence for linkage between regulatory enzymes in glycolysis and schizophrenia in a multiplex sample". American Journal of Medical Genetics. Part B, Neuropsychiatric Genetics. 127B (1): 5–10. doi:10.1002/ajmg.b.20132. PMID 15108172. S2CID 2420843。
関連文献
[編集]- Van Schaftingen E, Hers HG (1981). "Phosphofructokinase 2: the enzyme that forms fructose 2,6-bisphosphate from fructose 6-phosphate and ATP". Biochem. Biophys. Res. Commun. 101 (3): 1078–84. doi:10.1016/0006-291X(81)91859-3. PMID 6458291。
外部リンク
[編集]Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.

