コネクシン
| コネクシン | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 開いたギャップ結合のモデル。コネクシンは4回膜貫通タンパク質で、6分子のコネクシンが集合し、ギャップ結合の片側のチャネルを構成する。 | |||||||||||
| 識別子 | |||||||||||
| 略号 | Connexin | ||||||||||
| Pfam | PF00029 | ||||||||||
| InterPro | IPR013092 | ||||||||||
| PROSITE | PDOC00341 | ||||||||||
| TCDB | 1.A.24 | ||||||||||
| OPM superfamily | 215 | ||||||||||
| OPM protein | 2zw3 | ||||||||||
| |||||||||||
コネクシンまたはコネキシン (Connexin) は脊椎動物に見られる一群の膜貫通タンパク質で、ギャップ結合を形成する。無脊椎動物のギャップ結合を形成するイネキシンとは構造的に関連がない[1]。ギャップ結合は、コネクソンと呼ばれるヘミチャネル(半チャネル)の対から構成され、ヘミチャネルは6分子のコネクシンから構成される。心筋の協調した脱分極や胚の適切な発達、微小血管系での伝導反応等、多くの生理過程に必須であり、コネクシンをコードする遺伝子の突然変異は、機能や発達の異常に繋がる。
構造
[編集]
コネクシンは、C末端とN末端がともに細胞質側にある4回貫通型の膜貫通タンパク質で、細胞質ループ(CL)と2つの細胞外ループ(EL-1及びEL-2)からなる。コネクシン遺伝子ファミリーは多様であり、ヒトゲノムには21個、マウスのゲノムには20個の配列が同定されており、そのうち19個はオーソログ遺伝子である。これらの分子量は26-60 kDaで、平均で380アミノ酸長である。様々な組合せのコネクシンがギャップ結合を形成し、伝導性、サイズや電荷に対する選択性、開口電位・開口物質等の性質が少しずつ異なるものとなる。
命名
[編集]コネクシンはCxまたはCXと略称される。最近の論文では一般にその分子量によって命名され、例えば分子量26 kDaのものはCx26と呼ばれる。だが、生物種が異なるとオーソログタンパクの分子量が異なることがあり、例えばヒトのCx36は、ゼブラフィッシュのCx35と相同である。これはコネクシンを比較する際の混乱の元となることから、GJ (Gap Junction) 命名法と呼ばれる別の命名法が提案された。これはコネクシンをα型(GJA)とβ型(GJB)、さらにC、D、E型に分類し、これに同定番号を続けるものである。例えば、CX43/Cx43に対応するのは、GJA1/Gja1となる。2007年にヘルシンゲルで行われたギャップ結合会議における投票で、コネクシンをコードする遺伝子にはGJ命名法を用いることが決定されたが、ヒトタンパク質の分子量を用いて、そのオーソログとなるタンパク質を表すことで従来の命名法を残すことも希望された。
生合成と分解
[編集]コネクシンの際立った特徴の一つとして寿命が非常に短いということが挙げられ、半減期はわずか数時間しかない[2]。これはギャップ結合が動的に置換され続けているということを意味し、子宮筋層等の場所における細かい生理学的調整を可能としていると考えられる。
核から細胞膜まで
[編集]リボソームにより翻訳されたコネクシンは小胞体の膜に挿入される。ここでフォールディングが行われ、2つの細胞外ループEL-1とEL-2が形成される。続いて分子がオリゴマー化し、ヘミチャネルが作られ始める[2]。その後コネクシンは小胞体を出てVTC (Vesicular-tubular cluster) を経由し、シス・ゴルジ網に入る[3]。だが、Cx26等、ゴルジ体を経由せずに輸送されるコネクシンもある[4][5][6][7][8]。
ギャップ結合の組立て
[編集]細胞膜に挿入されたヘミチャネルは、脂質二重層中を自由に拡散する[9]。主にカドヘリン等の特定のタンパク質の助けを借りて、ヘミチャネルは隣接細胞のヘミチャネルと結合し、ギャップ結合を形成する[10]。近年の研究で、接着結合とギャップ結合の間の連絡が存在することが示され[11]、より高度な調整が行われていることが示唆される。
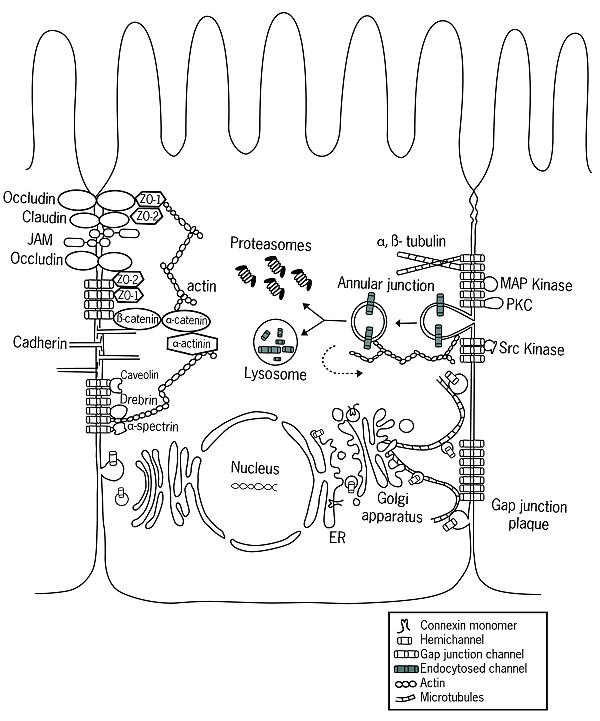
図の右側は、コネクシンの合成と分解経路を示す。コネクシンは小胞体 (ER) のリボソームで合成され、6分子が集合してコネクソンとなる。これは主にゴルジ体 (Golgi apparatus) からアクチンと微小管によって細胞膜に輸送され、隣接する細胞のコネクソンと結合してギャップ結合となる。ギャップ結合は細胞膜上に塊となって存在しているが、新しいコネクソンがその周辺に加わるにつれて、中央の古いコネクソンはAnnular junctionと呼ばれる構造を形成し、エンドサイトーシスによって細胞内に取り込まれていく。これはリソソームやプロテアソームで分解されるが、再利用されることもある(点線の経路)。
図の左側は、コネクソンと相互作用するタンパクを示す。細胞骨格上では、微小管やアクチン、アクチン結合タンパクのスペクトリン・ドレブリンと相互作用する。結合に関わるタンパクでは、接着結合を構成するカドヘリンやα-またはβ-カテニンの他、密着結合を構成するZO-1・ZO-2とも相互作用する。キナーゼやホスファターゼはチャネル組み立て・機能・分解の制御に関わる。他の相互作用タンパクとしてカベオリンがある[12]。
機能
[編集]コネクシンは脊椎動物のみで見られる。無脊椎動物で同等の機能を果たすタンパクとしてイネキシンがあるが、これはコネクシンと遺伝的に関連がない。イネキシンのオーソログは脊索動物でも同定されているが、ギャップ結合は形成しない。これらのタンパク質で形成されたパネキシンと呼ばれるチャネルは、細胞の内外を繋ぐ非常に大きな膜貫通孔として働く。
中枢神経系内で、ギャップ結合は前駆細胞・神経細胞・グリア細胞間を電気的に共役する。特定のコネクシンを不活化したノックアウトマウスを用いた研究で、視覚信号の伝達にはこれらの電気的共役が必須であることが明らかとなった。網膜内では、周囲の光強度がギャップ結合による細胞共役に影響を与え、照明条件に応じて視覚機能を調節する。これらの電気的共役はコネクシンの発現も含め、様々な機構により制御される[13]。
ヒトのコネクシンの一覧
[編集]| タンパク質 | 遺伝子 | 発現場所と機能 |
|---|---|---|
| Cx43 | GJA1 | 血管の表面で動脈硬化性プラークとともに発現し、アテローム性動脈硬化症のマウスでは強く発現していることから恐らく何らかの病理作用を持つ。また、顆粒膜細胞で発現し、その増殖に不可欠である。星状膠細胞でも発現し、ヒトの星膠細胞腫でも見られる[14]。心臓では主要なコネクシンであり、主に心室心筋で見られる[15]。眼歯指異形成症とも関連する。 |
| Cx46 | GJA3 | |
| Cx37 | GJA4 | 冠状動脈形成の際に血管平滑筋で誘導される。Cx37の変異は致死性ではない。卵母細胞と顆粒膜細胞の間のギャップ結合を形成し、卵母細胞が生き残るのに必要である。 |
| Cx40 | GJA5 | 心房筋細胞で選択的に発現する。心房の電気的活性の制御を仲介している[16]。 |
| Cx33 | GJA6 (GJA6P) |
ヒトでは偽遺伝子である。 |
| Cx50 | GJA8 | マウスのA型水平細胞や、ウサギの網膜の間のギャップ結合を構成する[17]。 |
| Cx59 | GJA10 | |
| Cx62 | GJA10 | ヒトのCx62は、マウスのCx57と相同である。ウサギの網膜のB型水平細胞に存在する[18]。 |
| Cx32 | GJB1 | 末梢性ミエリンのギャップ結合の主要構成成分である。ヒトではこの遺伝子の変異により、シャルコー・マリー・トゥース病が引き起こされる。ヒトの通常の脳内では、神経細胞と乏突起膠細胞で発現している[14]。 |
| Cx26 | GJB2 | 変異は掌蹠角皮症やKID症候群を引き起こす。 |
| Cx31 | GJB3 | 変異性紅斑角皮症と関連する可能性がある。 |
| Cx30.3 | GJB4 | Fonsecaらは、胸腺細胞でCx30.3が発現しているのを確認した[19]。変異性紅斑角皮症と関連する可能性がある。 |
| Cx31.1 | GJB5 | |
| Cx30 | GJB6 | 変異はクロウストン症候群を引き起こす。 |
| Cx25 | GJB7 | |
| Cx45 | GJC1/GJA7 | ヒトの膵臓の管状上皮細胞や[20]、房室結節で見られる。 |
| Cx47 | GJC2/GJA12 | 星状膠細胞のギャップ結合で発現する[21]。 |
| Cx30.2 | GJC3 | 内耳で発現する。有毛細胞でシグナル伝達のためのイオン輸送の役割を持っていると考えられている[22]。 |
| Cx36 | GJD2/GJA9 | 膵臓β細胞の機能を仲介し、インスリンを放出させる。中枢神経系の神経細胞では、神経活動を同期させる[23]。 |
| Cx31.9 | GJD3/GJC1 | |
| Cx39 | GJD4 | |
| Cx40.1 | GJD4 | |
| Cx23 | GJE1 | |
| Cx29 | GJE1 | ギャップ結合の形成は知られておらず、シュワン細胞のミエリンの最内層に存在する[24]。 |
出典
[編集]- ^ Lodish, Harvey F.; Arnold Berk; Paul Matsudaira; Chris A. Kaiser; Monty Krieger; Mathew P. Scott; S. Lawrence Zipursky; James Darnell (2004). Molecular Cell Biology (5th ed.). New York: W.H. Freeman and Company. pp. 230–1. ISBN 0-7167-4366-3
- ^ a b Laird DW (March 2006). “Life cycle of connexins in health and disease”. The Biochemical Journal 394 (3): 527–43. doi:10.1042/BJ20051922. PMC 1383703. PMID 16492141.
- ^ Musil, LS; Goodenough DA (1993). “Multisubunit assembly of an integral plasma membrane channel protein, gap junction connexin43, occurs after exit from the ER”. Cell 74 (6): 1065–77. doi:10.1016/0092-8674(93)90728-9. PMID 7691412.
- ^ Evans, W. H.; Ahmad, S., Diez, J., George, C. H., Kendall, J. M. and Martin, P. E. (1999). “Trafficking pathways leading to the formation of gap junctions”. Novartis Found. Symp.. Novartis Foundation Symposia 219: 44–54. doi:10.1002/9780470515587.ch4. ISBN 978-0-470-51558-7. PMID 10207897.
- ^ George, C. H., Kendall, J. M. and Evans, W. H. (1999). “Intracellular trafficking pathways in the assembly of connexins into gap junctions”. J. Biol. Chem. 274 (13): 8678–85. doi:10.1074/jbc.274.13.8678. PMID 10085106.
- ^ George, C. H., Kendall, J. M., Campbell, A. K. and Evans, W. H. (1998). “Connexin–aequorin chimerae report cytoplasmic calcium environments along trafficking pathways leading to gap junction biogenesis in living COS-7 cells”. J. Biol. Chem. 274 (45): 29822–9. doi:10.1074/jbc.273.45.29822. PMID 9792698.
- ^ Martin, P. E., George, C. H., Castro, C., Kendall, J. M., Capel, J., Campbell, A. K., Revilla, A., Barrio, L. C. and Evans, W. H. (1998). “Assembly of chimeric connexin–aequorin proteins into functional gap junction channels. Reporting intracellular and plasma membrane calcium environments”. J. Biol. Chem. 273 (3): 1719–26. doi:10.1074/jbc.273.3.1719. PMID 9430718.
- ^ Martin, P. E., Errington, R. J. and Evans, W. H. (2001). “Gap junction assembly: multiple connexin fluorophores identify complex trafficking pathways”. Cell Commun. Adhes. 8 (4–6): 243–8. doi:10.3109/15419060109080731. PMID 12064596.
- ^ Thomas, T., Jordan, K., Simek, J., Shao, Q., Jedeszko, C., Walton, P. and Laird, D. W. (2005). “Mechanisms of Cx43 and Cx26 transport to the plasma membrane and gap junction regeneration”. J. Cell Sci 118 (Pt 19): 4451–62. doi:10.1242/jcs.02569. PMID 16159960.
- ^ Jongen, W. M., Fitzgerald, D. J., Asamoto, M., Piccoli, C., Slaga, T. J., Gros, D., Takeichi, M. and Yamasaki, H. (1991). “Regulation of connexin 43-mediated gap junctional intercellular communication by Ca2+ in mouse epidermal cells is controlled by E- cadherin”. J. Cell Biol. 114 (3): 545–555. doi:10.1083/jcb.114.3.545. PMC 2289094. PMID 1650371.
- ^ Wei, C. J., Francis, R., Xu, X. and Lo, C. W. (2005). “Connexin43 associated with an N-cadherin-containing multiprotein complex is required for gap junction formation in NIH3T3 cells”. J. Biol. Chem. 280 (20): 19925–36. doi:10.1074/jbc.M412921200. PMID 15741167.
- ^ Dbouk HA, Mroue RM, El-Sabban ME, Talhouk RS (2009). “Connexins: a myriad of functions extending beyond assembly of gap junction channels”. Cell Commun. Signal 7: 4. doi:10.1186/1478-811X-7-4. PMC 2660342. PMID 19284610.
- ^ Kihara AH, de Castro LM, Moriscot AS, Hamassaki DE. (May 2006). “Prolonged dark adaptation changes connexin expression in the mouse retina”. J Neurosci Res 83 (7): 1331–41. doi:10.1002/jnr.20815. PMID 16496335.
- ^ a b Aronica E, Gorter J, Jansen G et al. (2001). “Expression of connexin 43 and connexin 32 gap-junction proteins in epilepsy-associated brain tumors and in the perilesional epileptic cortex”. Acta Neuropathol. 101 (5): 449–59. PMID 11484816.
- ^ Verheule S, van Kempen MJ, te Welscher PH, Kwak BR, Jongsma HJ (May 1997). “Characterization of gap junction channels in adult rabbit atrial and ventricular myocardium”. Circ. Res. 80 (5): 673–81. doi:10.1161/01.res.80.5.673. PMID 9130448.
- ^ Gollob MH et al. (June 22, 2006). “Somatic mutations in the connexin 40 gene (GJA5) in atrial fibrillation”. N Engl J Med 354 (25): 2677–88. doi:10.1056/NEJMoa052800. PMID 16790700.
- ^ Massey, Stephen (16 January 2009). Connexins: A Guide (1st ed.). Springer-Verlag Gmbh. pp. 3-?. ISBN 1-934115-46-0
- ^ Beyer, Eric C.; Berthound, Viviana M. (16 January 2009). Connexins: A Guide (1st ed.). Springer-Verlag Gmbh. pp. 387–417. ISBN 1-934115-46-0
- ^ Fonseca PC, Nihei OK, Urban-Maldonado M, Abreu S, de Carvalho AC, Spray DC, Savino W, Alves LA (June 2004). “Characterization of connexin 30.3 and 43 in thymocytes”. Immuno lett. 94 (1–2): 65–75. doi:10.1016/j.imlet.2004.03.019. PMID 15234537.
- ^ Tai M-H; Olson, LK; Madhukar, BV; Linning, KD; Van Camp, L; Tsao, MS; Trosko, JE (2003). “Characterization of Gap Junctional Intercellular Communication in Immortalized Human Pancreatic Ductal Epithelial Cells With Stem Cell Characteristics”. Pancreas 26 (1): e18–e26. doi:10.1097/00006676-200301000-00025. PMID 12499933.
- ^ Kamasawa N, Sik A, Morita M, et al. (2005). “Connexin-47 and connexin-32 in gap junctions of oligodendrocyte somata, myelin sheaths, paranodal loops and Schmidt-Lanterman incisures: implications for ionic homeostasis and potassium siphoning”. Neuroscience 136 (1): 65–86. doi:10.1016/j.neuroscience.2005.08.027. PMC 1550704. PMID 16203097.
- ^ del Castillo I et al. (January 24, 2002). “A deletion involving the connexin 30 gene in nonsyndromic hearing impairment”. N Engl J Med 346 (4): 343–9. doi:10.1056/NEJMoa012052. PMID 11807148.
- ^ Connors BW, Long MA (2004). “Electrical synapses in the mammalian brain”. Annu Rev Neurosci 27: 393–418. doi:10.1146/annurev.neuro.26.041002.131128. PMID 15217338.
- ^ Li X, Lynn BD, Olson C, et al. (September 2002). “Connexin29 expression, immunocytochemistry and freeze-fracture replica immunogold labelling (FRIL) in sciatic nerve”. Eur. J. Neurosci. 16 (5): 795–806. doi:10.1046/j.1460-9568.2002.02149.x. PMC 1803218. PMID 12372015.
外部リンク
[編集]![]() ウィキメディア・コモンズには、コネクシンに関するメディアがあります。
ウィキメディア・コモンズには、コネクシンに関するメディアがあります。
- Connexins - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
