Fluorène
| Fluorène | |
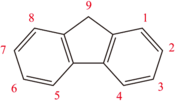  Structure du fluorène. |
|
| Identification | |
|---|---|
| Nom UICPA | 9H-Fluorène |
| Synonymes |
9H-Fluorène; |
| No CAS | |
| No ECHA | 100.001.541 |
| No CE | 201-695-5 |
| SMILES | |
| InChI | |
| Apparence | cristaux blancs |
| Propriétés chimiques | |
| Formule | C13H10 [Isomères] |
| Masse molaire[3] | 166,218 5 ± 0,011 1 g/mol C 93,94 %, H 6,06 %, |
| pKa | 22,6 (dans le DMSO)[1] |
| Susceptibilité magnétique | 110,5×10-6 cm3·mol-1[2] |
| Propriétés physiques | |
| T° fusion | 113 à 115 °C[4] |
| T° ébullition | 295 °C[4] |
| Solubilité | 1,8 mg·L-1 (eau)[4] |
| Masse volumique | 1,2 g·cm-3[4] |
| Point d’éclair | 152 °C[4] |
| Pression de vapeur saturante | 13 mbar à 146 °C[4] |
| Précautions | |
| SGH[6] | |
| H410, P273 et P501 |
|
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[5] | |
| Composés apparentés | |
| Isomère(s) | Phénalène |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le fluorène ou 9H-fluorène est un composé chimique de la famille des hydrocarbures aromatiques polycycliques (HAP). Il se présente sous la forme de cristaux blancs, dégageant une odeur proche de celle du naphtalène.
Contrairement à ce que son nom pourrait laisser supposer, cette molécule n'a rien à voir avec l'élément chimique fluor dont elle est dépourvue. Le nom de fluorène provient du fait que sous lumière ultraviolette (UV), le composé émet une lumière violette par fluorescence.
Propriétés
[modifier | modifier le code]Le fluorène est presque insoluble dans l'eau, mais soluble dans le benzène et l'éther. Les deux atomes d'hydrogène en position 9 sont acides, avec un pKA de 22,6 dans le DMSO. La réaction d'une base avec le fluorène donne donc un anion aromatique (de couleur orange très prononcée) très nucléophile. L'anion du fluorène est utilisé de façon similaire à celui du cyclopentadiène ou de l'indène comme ligand en chimie organométallique.
Occurrence
[modifier | modifier le code]Le fluorène est naturellement présent dans le goudron, plus précisément dans les fractions à haute température d'ébullition. Il est obtenu par distillation de ces fractions. On le trouve aussi en faible quantité, avec d'autres hydrocarbures polycycliques, dans les produits de chauffage ou de combustion en manque d'oxygène de substances organiques. On en trouve aussi des traces dans la combustion de l'essence ou du diesel.
Utilisations
[modifier | modifier le code]Le fluorène est utilisé pour fabriquer des matières plastiques, des colorants et des pesticides. Il est utilisé pour synthétiser la fluorénone, le fluorénol et le fluorène-9-méthanol
Le groupe fluorénylméthoxycarbonyle (Fmoc) est un groupe protecteur, utilisé dans la synthèse peptidique pour protéger les fonctions amines.
Le polyflurorène est utilisé comme luminophore dans les diodes électroluminescentes organiques (O-LED). Les copolymères de fluorène sont aussi étudiés pour la fabrication de cellules photovoltaïques.
Notes et références
[modifier | modifier le code]- Equilibrium acidities in dimethyl sulfoxide solution, F. G. Bordwell, Acc. Chem. Res.; 1988; 456-463, DOI 10.1021/ar00156a004
- (en) Hyp J. Dauben, Jr., James D. Wilson et John L. Laity, « Diamagnetic Susceptibility Exaltation in Hydrocarbons », Journal of the American Chemical Society, vol. 91, no 8, , p. 1991-1998
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Fluorene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 12/05/2009 (JavaScript nécessaire)
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur monographs.iarc.fr, CIRC, (consulté le ).
- SIGMA-ALDRICH
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Fluoren » (voir la liste des auteurs).
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Fluorene » (voir la liste des auteurs).
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.


