Typpihappo
Wikipediasta
| Typpihappo | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| Muut nimet | Salpietarihappo |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
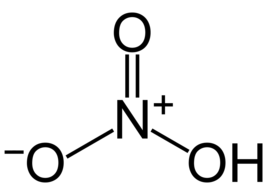
| Molekyylikaava | HNO3 |
| Moolimassa | 63,01 g/mol |
| Ulkomuoto | Kirkas, väritön neste |
| Sulamispiste | −42 °C (231 K) |
| Kiehumispiste | 83 °C (356 K) |
| Tiheys | 1,51 g/cm3 |
| Liukoisuus veteen | Liukenee helposti |

Typpihappo (aiemmin sievesi eli salpietarihappo[1]) eli HNO3 on väritön, voimakkaasti syövyttävä happo. Typpihappo on myös vahva hapetin. Joissakin tilanteissa typpihaposta voidaan käyttää nimitystä aqua fortis eli ”voimavesi”. Typpihappoa käytetään paljon lannoitteiden, räjähdysaineiden, väriaineiden ja lääkkeiden valmistamiseen. Typpihapon muodostamia suoloja kutsutaan nitraateiksi (NO3− on nitraatti-ioni). Nitraatit ovat vesiliukoisia.
Valmistus
[muokkaa | muokkaa wikitekstiä]Väitetään, että ensimmäisenä typpihapon synteesin kirjasi ylös arabialainen filosofi ja alkemisti Jabir ibn Hayyan noin vuonna 800.[2] Monet asiat, jotka ovat menneet Jabir ibn Hayyanin nimiin ovat kuitenkin todellisuudessa peräisin Espanjassa 1300-luvulla eläneeltä henkilöltä, joka otti käyttöönsä Jabarin latinisoidun nimen Geber saadakseen ajatuksilleen enemmän arvovaltaa.[3] William Newman arvelee, että Geber oli Paulus Tarentolainen, italialainen fransiskaanimunkki.[4]
Nykyään typpihappoa valmistetaan polttamalla ammoniakkia sopivan katalyytin läsnä ollessa. Kun reaktiossa syntyneisiin typen oksideihin sumutetaan vettä, oksidit liukenevat muodostaen typpihappoa. Reaktioyhtälöksi saadaan:
- 2NH3 + 3O2 → 2HNO3 + 2H2
Valmistus tapahtuu kahdessa vaiheessa. Ensin ammoniakki poltetaan (hapetetaan) kuumentamalla sitä hapen kanssa. Katalyyttinä reaktiossa käytetään platinaa ja rodiumia. Reaktiossa muodostuu typpioksidia ja vettä. Reaktio on erittäin eksoterminen, eli siinä vapautuu paljon lämpöä (ΔH = −950 kJ).
4 NH3(g) + 5 O2(g) → 4 NO(g) + 6 H2O(g)
Toisessa vaiheessa syntynyttä typpioksidia hapetetaan edelleen typpidioksidiksi:
2 NO(g) + O2(g) → 2 NO2(g)
Tämän jälkeen saatu typpidioksidi sekoitetaan veteen, jolloin muodostuu typpihappoa. Sivutuotteena syntyvä typpioksidi kierrätetään ja siitä valmistetaan taas typpidioksidia:
3 NO2(g) + H2O(l) → 2 HNO3(aq) + NO(g)
Vaihtoehtoisesti, jos reaktio toteutetaan ilmassa, typpidioksidi laitetaan reagoimaan hapen ja veden kanssa:
4NO2(g) + O2(g) + 2 H2O(l) → 4 HNO3(aq)
Kemialliset reaktiot
[muokkaa | muokkaa wikitekstiä]Typpihappo on vahva happo ja myös voimakas hapetin. Sen pKa on −1,4[5], joten laimeissa vesiliuoksissa se on lähes kokonaan protolysoituneena nitraatti-ioneiksi:
- HNO3 + H2O → NO3− + H3O+
Typpihappo on vahvasti syövyttävä aine. Se liuottaa hapettamalla kaikki metallit kultaa ja eräitä platinametalleja lukuun ottamatta.[6] Muista hapoista poiketen ei typpihapon reagoidessa metallin kanssa vapaudu vetyä, sillä varsinaisena hapettimena ei toimi protolyysissä vapautunut vetyioni vaan nitraatti-ioni, joka on vetyionia vahvempi hapetin. Tämän vuoksi se pystyy hapettamaan useita sellaisiakin metalleja, jotka ovat metallien jännitesarjassa vedyn jäljessä. Esimerkiksi kupari reagoi väkevässä typpihapon liuoksessa seuraavasti:[7]
Nitraatti-ionissa oleva typpi pelkistyy siis tällöin hapetusasteelta +V hapetusasteelle +III. Laimeassa liuoksessa tai voimakkaammin pelkistävän metallin ollessa kyseessä se saattaa pelkistyä pidemmällekin, jolloin voi syntyä typpioksidia, dityppioksidia tai jopa ammoniumioneja. Esimerkiksi sinkki reagoi hyvin laimeassa liuoksessa seuraavasti:[7]
- 4 Zn + 10 HNO3 → 4 Zn(NO3)2 + NH4NO3 + 3 H2O
Typpihapon ja suolahapon seos, kuningasvesi, hapettaa ja liuottaa myös kullan ja platinan.[7]
Typpihappo hapettaa myös useat epämetallit kuten rikin, fosforin ja jodin. Esimerkiksi rikin reagoidessa typpihapon kanssa syntyy rikkihappoa, typpidioksidia ja vettä:
- S + 6 HNO3 → H2SO4 + 6 NO2 + 2 H2O
Typpihapolla on myös taipumus sitoa itseensä proteiineja, jolloin esimerkiksi iho värjäytyy keltaiseksi jouduttuaan kontaktiin typpihapon kanssa.
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ https://runeberg.org/pieni/4/0515.html
- ↑ Nitric Acid—HNO3 windows.ucar.edu. Arkistoitu 29.1.2010. Viitattu 3.12.2007. (englanniksi)
- ↑ Geber Encyclopaedia Britannica.
- ↑ Newman, William: New Light on the Identity of Geber. Sudhoffs Archiv. Band 69, Heft 1, s. 76–90, 1985. Artikkelin verkkoversio.
- ↑ Antti Kivinen, Osmo Mäkitie: Kemia, s. 195. Otava, 1988. ISBN 951-1-10136-6.
- ↑ Otavan iso Fokus, 7. osa (Sv–Öö), s. 4 350, art. Typpihappo. Otava, 1974. 951-1-01521-4.
- ↑ a b c Kivinen, Mäkitie, s. 353–354
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- Typpihapon kansainvälinen kemikaalikortti
- OVA-ohje (Arkistoitu – Internet Archive)
- Kemian työsuojeluneuvottelukunta (KETSU): Typpihappo (Arkistoitu – Internet Archive)
- PubChem: Nitric Acid (englanniksi)
- KEGG: Nitric acid
- ChemBlink: Nitric acid
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.


