Toriumkloridi
Wikipediasta
| Toriumkloridi | |
|---|---|
 |
|
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | ThCl4 |
| Moolimassa | 373,849 |
| Ulkomuoto | Valkoisia, hygroskooppisia ja neulamaisia kiteitä[1] |
| Sulamispiste | 770 °C (1 040 K)[2](s. 80) |
| Kiehumispiste | 921 °C (1 194 K)[2](s. 80) |
| Tiheys | 4,59 g/cm3[3] |
| Liukoisuus veteen | Liukenee veteen |
Toriumkloridi tai torium(IV)kloridi (ThCl4) on torium- ja kloridi-ionien muodostama epäorgaaninen ioniyhdiste. Toriumkloridia ei esiinny vapaana luonnossa, vaan sitä saadaan monatsiitista ja muista toriummineraaleista. Yhdistettä käytetään valmistettaessa puhdasta toriummetallia ja muita toriumyhdisteitä.
Ominaisuudet
[muokkaa | muokkaa wikitekstiä]Toriumkloridi on huoneenlämpötilassa kiinteää valkoista ja hygroskooppista eli vettä imevää ainetta. Siitä tunnetaan kidevedettömän muodon lisäksi kaksi kidevedellistä hydraattia, nämä ovat ThCl4(H2O)4 ja ThCl4(H2O)8. Toriumkloridi liukenee veteen.[2]
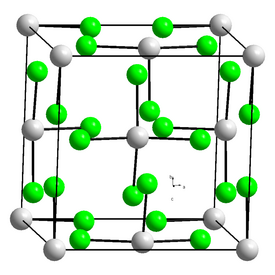
Toriumkloridilla on kaksi eri kiderakennetta eli se on polymorfista. Nämä ovat α‐ThCl4 ja korkean lämpötilan muoto β‐ThCl4. Kiderakenteiden välinen siirtymä tapahtuu 405 °C lämpötilassa, mutta vain erityisissä olosuhteissa ja erittäin puhtaalle näytteelle. Yhdisteen β‐muoto kuitenkin säilyy jäähtyessään takaisin alle tämän siirtymälämpötilan. Molempien muotojen kiderakenne on tetragonaalinen ja rakenteiden väliset erot ovat vähäisiä. α‐ThCl4:n avaruusryhmä on I41/amd (hilavakiot a = 640,8 pm, c = 1 292,4 pm) ja β‐ThCl4:n I41/a (hilavakiot a = 849,1 pm, c = 748,3 pm). On joitain viitteitä, että toriumkloridilla olisi kolmaskin olomuoto alle 70 K lämpötilassa.[2](s. 78-81)
Toriumin tavoin myös toriumkloridi on radioaktiivista.
Valmistus ja käyttö
[muokkaa | muokkaa wikitekstiä]Toriumkloridia voidaan valmistaa antamalla toriumhydridin ThH4 reagoida suolahapon kanssa tai suoraan kloorin reaktiolla toriummetallin, ThH4:n tai toriumkarbidin kanssa.[2](s. 80)
Toinen valmistustapa on kloorata toriumoksalaattia hiilidioksidin ja hiilitetrakloridin (CCl4) seoksella. Myös valmistus toriumdioksidista lähtien on mahdollista reaktioilla:
- ThO2 + 2 C + 2 Cl2 → ThCl4 + 2 CO
- ThO2 + 2 CCl4 → ThCl4 + 2 COCl2
Metallista toriumia voidaan valmistaa pelkistämällä toriumkloridia natriumilla tai elektrolysoimalla toriumkloridin sulatetta. Myös poikkeuksellinen reaktio dysprosiumkloridin DyCl2 kanssa tuottaa puhdasta toriummetallia.[2](s. 61)
Toriumkloridi on mahdollinen kaksoisfluidireaktorin polttoaine.[4]
Katso myös
[muokkaa | muokkaa wikitekstiä]- Toriumtrikloridi, paljon harvinaisempi toriumin kloridi
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ E. M. Karamäki: Epäorgaaniset kemikaalit, s. 501. Kustannusliike Tietoteos, 1983. ISBN 951-9035-61-3.
- ↑ a b c d e f Wickleder, Mathias S. et al.: ”luku 3”, Thorium, s. 52–160. Teoksessa: Morss, Lester R. et al. (toim.) The Chemistry of the Actinide and Transactinide Elements, 3. painos. Dordrecht: Springer, 2006. ISBN 1402035985. Teoksen verkkoversio (PDF). (englanniksi) (Arkistoitu – Internet Archive)
- ↑ Yaws, Carl L.: The Yaws Handbook of Physical Properties for Hydrocarbons and Chemicals, s. 802. Gulf Professional Publishing, 2015. ISBN 0128011467. Kirja Googlen teoshaussa (viitattu 13.3.2017). (englanniksi)
- ↑ He, Xun: Validation of the TRACE Code for the System Dynamic Simulations of the Molten Salt Reactor Experiment and the Preliminary Study on the Dual Fluid Molten Salt Reactor (PDF) (Väitöskirja) mediaTUM – der Medien- und Publikationsserver der Technischen Universität München. 14.6.2016. München: Technische Universität München. ”sivu 35: In particular, instead of the traditional UOX or MOX fuel (e.g. UOx, PuOx or ThOx), the fuel used in MSR is usually in the form of the fluoride or chloride (UClx, PuClx or ThClx)” Viitattu 4.3.2017. (englanniksi)
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- PubChem: Thorium chloride (englanniksi)
- ChemBlink: Thorium chloride (englanniksi)
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.

