Antitrombiini
Wikipediasta
| Antitrombiini | |

| |
| Ihmisen antitrombiini (PDB: 2ANT) | |
| Tunnisteet | |
| Tietokannat | |
| Entrez | 462 |
| OMIM | 107300 |
| UniProt | P01008 |
Antitrombiini (geeni SERPINC1) eli antitrombiini III[1] on muun muassa ihmisten veressä oleva glykoproteiini ja yksi kehon tärkeimmistä veren hyytymisen estäjistä.[2] Se estää liikaa hyytymistä sitoutumalla kovalenttisesti hyytymistä aiheuttaviin seriiniproteaaseihin, joita ovat trombiini, kallikreiini, tekijät IXa, Xa, XIa ja XIIa. Se estää myös seriiniproteaaseihin kuuluvaa plasmiinia,[1] joka ei aiheuta hyytymistä vaan estää sitä.[2] Antitrombiini on siis seriiniproteaasien estäjä eli serpiini eikä ole entsyymi. Veressä luontaisesti ilmenevä ja lääkkeenä käytetty hepariini tehostaa sen estävää toimintaa noin 1000-kertaisesti sitoutumalla siihen. Antitrombiinin geneettinen puutos altistaa veritulpille.[1]
Geeni
[muokkaa | muokkaa wikitekstiä]Ihmisillä antitrombiinin geeni on SERPINC1. Se on kromosomissa 1 kohdassa 1q23–25. Sen pituus on 13 574 emäsparia (bp). Siinä on 6 intronia ja 7 eksonia. 11 980 bp eli 88 % geenistä ei koodaa antitrombiinia.[3] Eksonien nimet ovat 1, 2, 3A, 3B, 4, 5 ja 6.[1]
Rakenne
[muokkaa | muokkaa wikitekstiä]Ihmisten antitrombiinin esiasteessa on translaation jälkeen 464 aminohappoa (AH). Translaation jälkeen se muun muassa glykosyloituu ja siitä poistuu 32 AH:n signaalisekvenssi.[1]
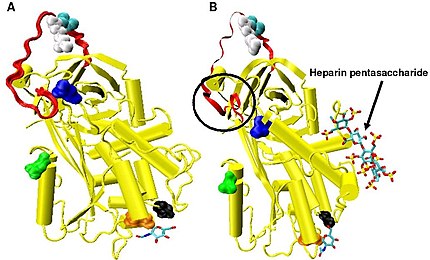
Valmis antitrombiini on 432 AH:n glykoproteiini, jonka massa on noin 58 kDa. Siinä on 2 merkittävää aluetta: reaktiivinen kohta/silmukka ja N-terminaalia lähellä oleva hepariinia sitova kohta, johon hepariini kiinnittyy tehostaen antirombiinin tehoa allosteerisesti. Antitrombiinissa on hiilihydraatit asparagiineissä (N) 96, 135, 155 ja 192. 5–10 %:ssa veriplasman antitrombiinista puuttuu asparagiinin 135 hiilihydraatti – tätä muotoa sanotaan β-antitrombiiniksi. Sillä on suurempi affiniteetti hepariinille kuin täysin glykosyloidulla antitrombiinilla,[4] jota sanotaan eron tekemiseksi joskus myös α-antitrombiiniksi.[2]
Antitrombiini on serpiini ja muistuttaa rakenteeltaan muita serpiinejä: siinä on 9 α-kierrettä ja 3 β-levyrakennetta, joissa on 6, 6 ja 4 β-levyä.[4]
Toiminta
[muokkaa | muokkaa wikitekstiä]Ihmisillä antitrombiini muodostuu pääosin maksassa, josta se vapautuu vereen. Sen pitoisuus veriplasmassa on noin 2.5 µmol/l ja puoliintumisaika 60–70 tuntia.[1]
Antitrombiini on TFPI:n ja proteiini C:n lisäksi pääasiallinen veren hyytymistä estävä tekijä.[2] Se kiertää veressä aktiivisena ja estää hyytymisreaktiossa seriiniproteaaseihin kuuluvaa trombiinia, tekijöitä IXa, Xa, XIa, XIIa, kallikreiiniä ja plasmiinia. Antitrombiinin estävä toiminta tehostuu noin 1000-kertaisesti sen sitoessa hepariinia, jonka kanssa se muodostaa kompleksin suhteessa 1:1.[1] Seriiniproteaasit kiinnittyvät antitrombiinin reaktiiviseen kohdan aminohapposilmukkaan, joka muistuttaa proteaasien pilkkomia proteiineja. Silmukka katkeaa ja sen arginiini 393 kiinnittyy kovalenttisesti proteaasiin. Suhteessa 1:1 muodostuneen proteaasi-antitrombiinikompleksin proteaasi ei enää pysty osallistumaan veren hyytymiseen. Tämä on ns. itsemurhamekanismi, sillä yksittäinen antitrombiini ei estoreaktion jälkeen voi enää estää muita proteaaseja.[5]
Mutaatiot ja puutokset
[muokkaa | muokkaa wikitekstiä]Ihmisillä antitrombiinin toiminnan heikkous sitä koodaavan mutaation takia aiheuttaa autosomaalisesti ja dominantisti periytyvää alttiutta saada veritulppia. Puutos ilmenee 70–160 ihmisellä 100 000:sta.[1] Veritulpan saantiriski on noin 20–40-kertainen ja puutos aiheuttaa noin 1 % kaikista todetuista syvistä laskimotukoksista.[3]
Useita eri mutaatiotyyppejä tunnetaan ja puutos voidaan jakaa tyyppiin I ja II. Tyypissä I antirombiinin toiminta on heikentynyt ja sitä on veressä noin 50 % normaalia vähemmän. Tyypin II puutoksessa sen veripitoisuus on normaali, mutta sen toiminta on heikentynyt. Tyyppi II voidaan vielä jakaa alatyyppeihin IIa, IIb ja IIc. IIa-mutaatiot kohdistuvat antitrombiinin reaktiiviseen kohtaan, IIb hepariinia sitovaan kohtaan ja IIc reaktiivisen kohdan lähialueisiin. Tyyppiä I tai IIa potevat ovat heterotsygootteja, sillä homotsygotia tappaa sikiövaiheessa (keskenmeno). Muita puutostyyppejä potevat voivat olla hetero- tai homotsygootteja.[1]
Veren antitrombiinipitoisuuksia laskevat myös sen tuottoa vähentävät tekijät, kuten kirroosi, aliravitsemus ja keskosuus. Syynä voivat olla myös kulutusta lisäävät tekijät, kuten akuutti veritulppa, hepariiniterapia, verenmyrkytys tai verensiirto.[1]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d e f g h i j CS Kitchens et al: Consultative hemostasis and thrombosis, s. 217. 3. painos. Elsevier/Saunders, 2013. ISBN 9781455722969. doi:10.1016/C2009-0-64563-3.
- ↑ a b c d A Porwit et al: Blood and bone marrow pathology, s. 585-587. 2. painos. Elsevier, 2011. ISBN 9780702031472. doi:10.1016/C2009-0-52942-X.
- ↑ a b ME Morena‐Barrio et al: Defects of splicing in antithrombin deficiency. Research and Practice in Thrombosis and Haemostasis, 2017, 1. vsk, nro 2, s. 216–222. PubMed:30046692. doi:10.1002/rth2.12025. ISSN 2475-0379. Artikkelin verkkoversio.
- ↑ a b K Tanaka et al: Recent advances in thrombosis and hemostasis 2008, s. 197. Springer, 2008. ISBN 9784431788478. doi:10.1007/978-4-431-78847-8.
- ↑ ST Olson et al: Molecular mechanisms of antithrombin-heparin regulation of blood clotting proteinases. A paradigm for understanding proteinase regulation by serpin family protein proteinase inhibitors. Biochimie, 2010, 92. vsk, nro 11, s. 1587–1596. PubMed:20685328. doi:10.1016/j.biochi.2010.05.011. ISSN 0300-9084. Artikkelin verkkoversio.
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
