Silicij-dioksid
| Silicij-dioksid | |
|---|---|
 | |
| Općenito | |
| Hemijski spoj | Silicij-dioksid |
| Druga imena | Silicij (IV) oksid, kvarc, kremen |
| Molekularna formula | SiO2 |
| CAS registarski broj | 7631-86-9 |
| Kratki opis | bijela praškasta supstanca |
| Osobine1 | |
| Molarna masa | 60,1 g/mol |
| Agregatno stanje | čvrsto |
| Gustoća | 2.2 g/cm3 |
| Tačka topljenja | 1650 (±75) °C |
| Tačka ključanja | 2230 °C |
| Rastvorljivost | 0.012 g u 100 g |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Silicij-dioksid (SiO2) javlja se u tri alotropske modifikacije: kvarc, tridimit i kristobalit. Svaki od ova tri oblika postoji još u dvije modifikacije (α i β)
Hemijske osobine
[uredi | uredi izvor]Silicij-dioksid prilično je inertan. Ne reagira s kiselinama, osim sa fluorovodoničnom kiselinom (HF). Taljenjem s alkalnim hidroksidima prelazi u rastvorljive silikate:
- SiO2 + 2 NaOH → Na2SiO3 + H2O
Kiselina koja odgovara silicij-dioksidu naziva se ortosilikatna kiselina, ali se ne može dobiti kao kod oksida nemetala rastvaranjem u vodi, jer je silicij-oksid netopiv u vodi i organskim otapalima[1]. Najlakši način je hidroliza silicij-tetrahlorida:
- SiCl4 + 4 H2O → H2SiO4 + 4 H+ + 4 Cl-
Ova kiselina u monomolekularnom obliku postoji pri pH oko 3,2. Pri nižim ili višim vrijednostima počinje polimerizirati.
Soli silikatnih kiselina nazivaju se silikati. Samo se alkalni silikati rastvaraju u vodi. Polimerizirana silikatna kiselina prelazi u gel, čijim sušenjem nastaje silikagel.
Upotreba
[uredi | uredi izvor]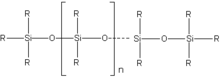
Silicij-dioksid jedna je od osnovnih komponenata u proizvodnji stakla. Važnu grupu minerala čine silikatni minerali. Zamjenom OH-grupa u silikatnoj kiselini organskim radikalima moguće je kontrolirati reakciju kondenzacije, pri čemu nastaju polimerni spojevi strukture slične ketonima R2C=O, pa se nazivaju silikoketoni ili silikoni.
Reference
[uredi | uredi izvor]Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.

