Hemijska formula
Hemijska formula je jedan od načina predstavljanja informacija o hemijskim proporcijama atoma koji čine određeni hemijski spoj ili molekulu, koristeći simbole hemijskih elemenata, brojeve, a ponekad i druge simbole, poput umetanja, crtica, zagrada, zareza i znakova plus (+) i minus (–). Oni su ograničeni na jednu tipografsku liniju simbola, koja može uključivati indekse i natpise. Hemijska formula nije hemijski naziv i ne sadrži riječi. Iako hemijska formula može podrazumijevati određene jednostavne hemijske strukture, to nije isto što i puna hemijska strukturna formula. Hemijske formule mogu u potpunosti odrediti strukturu samo najjednostavnijih molekula i hemijskih supstanci, i uglavnom su ograničenije snage hemijskih imena i strukturnih formula.
Najjednostavnije vrste hemijskih formula nazivaju se empirijske formule, koje koriste slova i brojeve koji označavaju numeričke proporcije atoma svake vrste. Molekulske formule označavaju jednostavne brojeve svake vrste atoma u molekulu, bez podataka o strukturi. Naprimjer, empirijska formula za glukozu je CH2O(dvostruko više atoma vodika od ugljika i kisika), dok je njegova molekulska formula.
Hemijska formula je zapis sastava hemijskog spoja pomoću hemijskih simbola. Hemijska formula može biti:
- Empirijska formula, koja navodi elemente spoja u njihovom međusobnom omjeru. Primjer: CnH2n; u spoju označava omjer vodonika i ugljika 1:2. Spojevi s takvim sastavom su obično veliki, npr. svi alkeni ili cikloalkani.
- Strukturna formula, koja uz omjer pojedinog spoja navodi valenciju i razpored atoma u molekuli.
- Molekulska formula, koja navodi broj atoma elementa u pojedinom spoju. Primjer: butan - C4H10
Definicija
[uredi | uredi izvor]| Aluminij-sulfat ima hemijsku formulu Al2(SO4)3. Oblik aluminij-sulfat heksadekahidrata je Al2(SO4)3·16 H2O. |
| Strukturna formula butana. Primjeri drugih hemijskih formula za butan su C2H5, molekulska formula C4H10 i kondenzirana (ili semistrukturna) formula CH3CH2CH2CH3. |
Hemijska formula je jedan od načina predstavljanja informacija o hemijskim proporcijama atoma koji čine određeni hemijski spoj ili molekulu, koristeći simbole hemijskih elemenata, brojeve, a ponekad i druge simbole, poput umetanja, crtica, zagrada, zareza i znakova plus (+) i minus (–). Oni su ograničeni na jednu tipografsku liniju simbola, koja može uključivati indekse i natpise. Hemijska formula nije hemijski naziv i ne sadrži riječi. Iako hemijska formula može podrazumijevati određene jednostavne hemijske strukture, to nije isto što i puna hemijska strukturna formula. Hemijske formule mogu u potpunosti odrediti strukturu samo najjednostavnijih molekula i hemijskih supstanci, i uglavnom su ograničenije snage hemijskih imena i strukturnih formula.[1] [2]
Najjednostavnije vrste hemijskih formula nazivaju se empirijske formule, koje koriste slova i brojeve koji označavaju numeričke proporcije atoma svake vrste. Molekulske formule označavaju jednostavne brojeve svake vrste atoma u molekulu, bez podataka o strukturi. Naprimjer, empirijska formula za glukozu je CH2O(dvostruko više atoma vodika od ugljika i kisika), dok je njegova molekulska formula.
Tako npr. formula H2O označava molekulu vode, koja se sastoji od dvaju atoma vodika (H) i jednog atoma kisika (O).
| Spoj | Empirijska formula | Molekulska formula | Sažeta strukturna formula | Strukturna formula | Projekcijska formula |
|---|---|---|---|---|---|
| Hlorovodik | HCl | HCl | HCl | HCl | |
| Acetatna kiselina | CH2O | C2H4O2 | CH3-CO-OH |  |
|
| Etin | CH | C2H2 | HCΞCH | H-CΞC-H | |
| Benzen | CH | C6H6 | 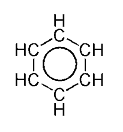 |
 |
|
| Etanol | C2H6O | C2H6O | CH3-CH2-OH |  |
|
| Metoksimetan | C2H6O | C2H6O | CH3-O-CH3 |  |
|
| Mliječna kiselina | CH2O | C3H6O3 | CH3-CH(OH)-COOH |  |
|
| Glukoza | CH2O | C6H12O6 | HOCH2-[CH(OH)]4-CHO | 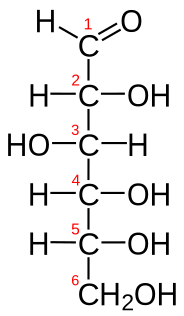 Fischerova Fischerova |

|
Formulska jedinica
[uredi | uredi izvor]Formulsku jedinica je najmanji omjer broja aniona i kationa u ionskom spoju koji prikazujemo formulom spoja. Ionska tvar je ogroman skup aniona i kationa koji su povezani ionskom vezom (elektrostatskom). U ionskoj tvari naizmjenično su raspoređeni anioni i kationi, odnosno svaki anion je okružen određenim brojem kationa i obrnuto. Ne postoji molekula ionskog spoja već je cijeli spoj jedna „velika molekula”. Zato formula ionskog spoja ima samo najmanji omjer broja aniona i kationa u spoju, odnosno prikazuje formulsku jedinku. Formula CaCl2 govori da se u kalcij-hloridu kationi (Ca2+) i anioni (Cl–) nalaze u omjeru 1:2 te je CaCl2 formulska jedinka kalcij-hlorida.[3][4]
U najširem smislu svaka formula predstavlja formulsku jedinku.
Formule hidratnih soli
[uredi | uredi izvor]Kristali hidratnih soli imaju u sastavu vezanu kristalnu vodu. Formula spoja se piše, naprimjer: CuSO4∙5H2O. Tačka u formuli ne predstavlja znak množenja već je znak sabiranja (plus). Voda je uklopljena u kristalnu strukturu spoja. Napisana formula je sažeti oblik pisanja. Zapravo formulu bi pravilnije trebalo pisati kao: [Cu(H2O)4]SO4∙H2O. Četiri molekule vode se koordiniraju s ionom bakra, dok je peta molekula vode povezana sa sulfatnim ionom. Također, MgSO4∙7H2O zapravo je [Mg(H2O)6]SO4∙H2O. Uglaste zagrade u pisanju koriste se za kreiranje formula kompleksnih spojeva.
Formule kompleksnih spojeva
[uredi | uredi izvor]Formule kompleksnih spojeva, sažeto se pišu kao u prethodnim primjerima, ali najprizornije je formulu prikazati „trodimenzijski”.
-
Bakar-tetraaminosulfat hidtat [Cu(NH3)4]SO4·H2O
-
Rodijev pentaminotriklorid [Rh(NH3)5Cl]Cl2
Tipovi hemijskih formula
[uredi | uredi izvor]Hemijske formule razlikuju se prema informacijama koje pružaju.
- Formula elementarne tvari predočuje molekulu odnosno skup istovrsnih atoma koji se nalaze u molekuli elementarne tvari (H2, P4, S8)
- Empirijska formula pokazuje samo relativne omjere broja pojedinih atoma u jedinki, a određuje se na temelju masenih udjela pojedinih elemenata u spoju dobivenih elementarnom analizom.
- Molekulska formula pokazuje tačan broj atoma u spoju (molekuli), a određuje se iz empirijske formule i poznate molekulske mase.
- Strukturna formula prikazuje način povezivanja atoma u molekuli, a određuje se nakon identifikacije funkcionalnih grupa molekule (alkoholna, aldehidna, kiselinska, aminska i dr.), najčešće spektroskopskim tehnikama.
- Sažeta strukturna formula je strukturna formula napisana jednostavnije, često u jednom redu, prikazane su atomske grupe i atomi ali način njihovog povezivanja nije posve jasan.
- Stereohemijska formula prikazuje prostornu orijentaciju atoma u molekuli različitim tipovima projekcija koje uključuju mnoge dodatne konvencije. Prostorni raspored atoma izravno se određuje difrakcijskim metodima strukturne analize.
Formulska jedinica
[uredi | uredi izvor]Formulsku jedinica je najmanji omjer broja aniona i kationa u ionskom spoju koji prikazujemo formulom spoja. Ionska tvar je ogroman skup aniona i kationa koji su povezani ionskom vezom (elektrostatskom). U ionskoj tvari naizmjenično su raspoređeni anioni i kationi, odnosno svaki anion je okružen određenim brojem kationa i obrnuto. Ne postoji molekula ionskog spoja već je cijeli spoj jedna „velika molekula”. Zato formula ionskog spoja ima samo najmanji omjer broja aniona i kationa u spoju, odnosno prikazuje formulsku jedinku. Formula CaCl2 govori da se u kalcij-hloridu kationi (Ca2+) i anioni (Cl–) nalaze u omjeru 1:2 te je CaCl2 formulska jedinka kalcij-hlorida.
U najširem smislu svaka formula predstavlja formulsku jedinku.
Formule hidratnih soli
[uredi | uredi izvor]Kristali hidratnih soli imaju u sastavu vezanu kristalnu vodu. Formula spoja se piše, naprimjer: CuSO4∙5H2O. Tačka u formuli ne predstavlja znak množenja već je znak sabiranja (plus). Voda je uklopljena u kristalnu strukturu spoja. Napisana formula je sažeti oblik pisanja. Zapravo formulu bi pravilnije trebalo pisati kao: [Cu(H2O)4]SO4∙H2O. Četiri molekule vode se koordiniraju s ionom bakra, dok je peta molekula vode povezana sa sulfatnim ionom. Također, MgSO4∙7H2O zapravo je [Mg(H2O)6]SO4∙H2O. Uglaste zagrade u pisanju koriste se za kreiranje formula kompleksnih spojeva.
Formule kompleksnih spojeva
[uredi | uredi izvor]Formule kompleksnih spojeva, sažeto se pišu kao u prethodnim primjerima, ali najprizornije je formulu prikazati „trodimenzijski”.
-
Bakar-tetraaminosulfat hidtat [Cu(NH3)4]SO4·H2O
-
Rodijev pentaminotriklorid [Rh(NH3)5Cl]Cl2
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Burrows, Andrew. (21. 3. 2013). Chemistry : introducing inorganic, organic and physical chemistry (Second izd.). Oxford. ISBN 978-0-19-969185-2. OCLC 818450212.
- ^ Chai, Yan; Guo, Ting; Jin, Changming; Haufler, Robert E.; Chibante, L. P. Felipe; Fure, Jan; Wang, Lihong; Alford, J. Michael; Smalley, Richard E. (1991). "Fullerenes wlth Metals Inside". Journal of Physical Chemistry. 95 (20): 7564–7568. doi:10.1021/j100173a002.
- ^ Edwin A. Hill (1900). "On a system of indexing chemical literature; Adopted by the Classification Division of the U.S. Patent Office". J. Am. Chem. Soc. 22 (8): 478–494. doi:10.1021/ja02046a005. hdl:2027/uiug.30112063986233.
- ^ Wiggins, Gary. (1991). Chemical Information Sources. New York: McGraw Hill. p. 120.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.

![Bakar-tetraaminosulfat hidtat [Cu(NH3)4]SO4·H2O](https://upload.wikimedia.org/wikipedia/commons/thumb/2/2f/Tetraminkupfersulfathydrat.png/120px-Tetraminkupfersulfathydrat.png)
![Rodijev pentaminotriklorid [Rh(NH3)5Cl]Cl2](https://upload.wikimedia.org/wikipedia/commons/thumb/8/8d/%28RhA5Cl%29Cl2.png/120px-%28RhA5Cl%29Cl2.png)

