Grignard-reagens
'n Grignard-reagens (of Grignard-verbinding) is 'n chemiese verbinding met die generiese formule R−Mg−X, waar X 'n halogeen is en R 'n organiese groep is, gewoonlik 'n alkiel of ariel. Twee tipiese voorbeelde is metielmagnesiumchloried CH3−Mg−CL en fenielmagnesiumbromied (C6H5)−Mg−Br. Dit is 'n subklas van die organomagnesiumverbindings.
Grignard-verbindings is gewilde reagense in organiese sintese om nuwe koolstof-koolstofbindings te skep. As hulle byvoorbeeld reageer met 'n ander gehalogeneerde verbinding R'-X' in die teenwoordigheid van 'n geskikte katalisator, lewer dit tipies R-R' en die magnesiumhalogenied MgXX' as 'n neweproduk. Dit is ook onoplosbaar in die oplosmiddels wat normaalweg vir sintese gebruik word.
Suiwer Grignard-reagense is uiters reaktiewe vaste stowwe. Hulle word normaalweg gehanteer as oplossings in oplosmiddels soos diëtieleter of tetrahidrofuraan; wat relatief stabiel is solank water uitgesluit word. In so 'n medium is 'n Grignard-reagens altyd teenwoordig as 'n kompleks met die magnesiumatoom wat deur koördinasiebindings aan die twee eteroksiede verbind is.
François Auguste Victor Grignard het in 1900 die reaksie wat na hom vernoem is ontdek, en is in 1912 met die Nobelprys daarvoor vereer.[1]
Sintese
[wysig | wysig bron]Grignard-reagense word voorberei deur 'n organiese halied (gewoonlik organobroomverbindings) met magnesiummetaal te behandel. Water en lug vernietig die reagens vinnig, daarom word dit geproduseer en in 'n oplosmiddel gestoor. Die reaksie behels magnesiummetaal wat normaalweg met 'n laag magnesiumoksied bedek is. Die oksiedlaag word verwyder deur fisiese metodes soos die verplettering van die Mg-stukke, of deur gebruik te maak van aktiveermiddels soos jodium, metieljodied of 1,2-dibroometaan. Sodra die oksiedlaag verwyder is, is die reaksie hoogs eksotermies.
Reaksies van Grignard-reagense
[wysig | wysig bron]Met karbonielverbindings
[wysig | wysig bron]
Die mees algemene toepassing van Grignard-reagense is die alkilering van aldehiede en ketone, deur die Grignard-reaksie.[2]

Met ander verbindings
[wysig | wysig bron]
Kommersiële gebruike
[wysig | wysig bron]Grignard-reagense is nukleofiele in nukleofiele alifatiese substitusiereaksies, byvoorbeeld met halogenoalkane, in 'n belangrike stap in die industriële produksie van Naproxen, 'n nie-steroïdale anti-inflammatoriese middel wat onder die naam Aleve verkoop word:
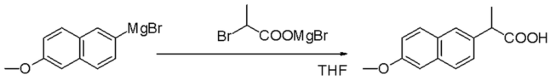
Die Grignard-reaksie is 'n belangrike stap in die (nie-stereoselektiewe) industriële produksie van Tamoxifen[3] (wat tans gebruik word vir die behandeling van estrogeenreseptor-positiewe borskanker by vroue):[4]

Verwysings
[wysig | wysig bron]- ↑ "The Nobel Prize in Chemistry 1912 - Victor Grignard - Biographical". NobelPrize.org (in Engels). 11 Mei 1913. Besoek op 14 Oktober 2020.
- ↑ Haugan, Jarle André; Songe, Pål; Rømming, Christian; Rise, Frode; Hartshorn, Michael, P.; Merchán, Manuela; Robinson, Ward T.; Roos, Björn O.; Vallance, Claire; Wood, Bryan R. (1997). "Total Synthesis of C31-Methyl Ketone Apocarotenoids 2: The First Total Synthesis of (3R)-Triophaxanthin" (PDF). Acta Chemica Scandinavica (in Engels). 51: 1096–1103. doi:10.3891/acta.chem.scand.51-1096. Besoek op 26 November 2009.
((cite journal)): AS1-onderhoud: meer as een naam (link) - ↑ Richey, Herman Glenn (2000). Grignard Reagents: New Developments (in Engels). Wiley. ISBN 978-0-471-99908-9. OCLC 42004415.
- ↑ Jordan, V.C. (1993). "Fourteenth Gaddum Memorial Lecture. A current view of tamoxifen for the treatment and prevention of breast cancer". Br J Pharmacol (in Engels). 110 (2): 507–17. doi:10.1111/j.1476-5381.1993.tb13840.x. PMC 2175926. PMID 8242225.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
