S100
Матеріал з Вікіпедії — вільної енциклопедії.
| S100 | |
|---|---|
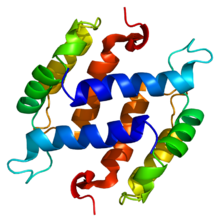 Тривимірна структура протеїну S100B | |
| Ідентифікатори | |
| Символ | S_100 |
| Інша інформація | |
S100 — це родина протеїнів, що налічує близько 21 членів та характеризується невеликою молекулярною вагою та двома кальцій-зв'язуючими сайтами в структурі білка за типом спіраль-поворот-спіраль (EF-hand).[1] Назва S100 походить від властивостей представників цієї родини протеїнів розчинятись в сульфаті амонію.
Більшість S100 — це гомодимери, що складаються з двох ідентичних поліпептидів, зв'язаних не-ковалентними зв'язками. Не зважаючи на те, що структура S100 схожа на структуру кальмодуліну, ці два протеїна відрізняються за рівнем експресії в різних клітинах, і експресія залежить від факторів зовнішнього середовища.
S100 експресуються переважно в клітинах, що походять з нервового гребеня (Шваннівські клітини, меланоцити, гліальні клітини), хондроцити, адипоцити, міоепітеліальні клітини, макрофаги, клітини Лангерганса, дендритні клітини, кератиноцити; експресія S100 може бути в деяких епітеліальних клітинах молочної залози. S100 залучені до регуляції різноманітних клітинних процесів та позаклітинних функцій. S100 беруть участь в регуляції фосфорелювання, роботи транскрипційних факторів, гомеостазу кальцію та динаміки компонентів цитоскелету, активності ензимів, клітинного росту та диференціації, а також запаленні.
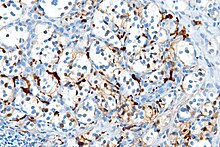
Порушення експресії S100 спостерігається при різноманітних злоякісний новоутвореннях, зокрема при меланомі, гістіоцитомі, парагангліомі, папілярному раку щитоподібної залози (протеїн S100A6).[2]
- S100A1, S100A2, S100A3, S100A4, S100A5, S100A6, S100A7, S100A8, S100A9, S100A10, S100A11, S100A12, S100A13, S100A14, S100A15, S100A15, S100A16
- S100B
- S100P
- S100Z
- ↑ Marenholz I, Heizmann CW, Fritz G (October 2004). S100 proteins in mouse and man: from evolution to function and pathology (including an update of the nomenclature). Biochem. Biophys. Res. Commun. 322 (4): 1111—22. doi:10.1016/j.bbrc.2004.07.096. PMID 15336958.
- ↑ Sofiadis A, Dinets A, Orre LM, Branca RM, Juhlin CC, Foukakis T, Wallin G, Höög A, Hulchiy M, Zedenius J, Larsson C, Lehtiö J. (October 2010). Proteomic study of thyroid tumors reveals frequent up-regulation of the Ca2+ -binding protein S100A6 in papillary thyroid carcinoma. Thyroid. 20 (10): 1067-76. doi:10.1089/thy.2009.0400.. PMID 20629554.
((cite journal)): Перевірте значення|doi=(довідка)
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
