โซเดียมออกซาเลต
| |
| ชื่อ | |
|---|---|
| Preferred IUPAC name
Disodium oxalate | |
| ชื่ออื่น
กรดออกซาลิก, เกลือไดโซเดียม,
Sodium ethanedioate | |
| เลขทะเบียน | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| เคมสไปเดอร์ | |
| ECHA InfoCard | 100.000.501 |
| EC Number |
|
ผับเคม CID
|
|
| RTECS number |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
InChI
| |
SMILES
| |
| คุณสมบัติ | |
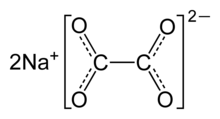
| Na2C2O4 | |
| มวลโมเลกุล | 133.999 g mol−1 |
| ความหนาแน่น | 2.34 g cm−3 |
| จุดหลอมเหลว | 260 องศาเซลเซียส (500 องศาฟาเรนไฮต์; 533 เคลวิน) สลายตัวในอุณหภูมิมากกว่า 290 °C[2] |
| 2.69 g/100 mL (0 °C) 3.7 g/100 mL (20 °C) 6.25 g/100 mL (100 °C) | |
| ความสามารถละลายได้ | ละลายในกรดฟอร์มิก ไม่ละลายในแอลกอฮอล์, อีเทอร์ |
| โครงสร้าง | |
| มอนอคลินิก | |
| อุณหเคมี | |
Std enthalpy of
formation (ΔfH⦵298) |
-1318 kJ/mol |
| ความอันตราย | |
| GHS labelling:[3] | |
Pictograms
|

|
Signal word
|
เตือน |
Hazard statements
|
H302, H312 |
Precautionary statements
|
P280, P301+P312, P302+P352 |
| NFPA 704 (fire diamond) | |
| ปริมาณหรือความเข้มข้น (LD, LC): | |
LD50 (median dose)
|
11160 mg/kg (ปาก, หนู)[1] |
| เอกสารข้อมูลความปลอดภัย (SDS) | Oxford MSDS แม่แบบ:Unreliable source |
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
โซเดียมออกซาเลต (อังกฤษ: sodium oxalate) หรือ ไดโซเดียมออกซาเลต (disodium oxalate) เป็นเกลือโซเดียมของกรดออกซาลิก มีสูตรเคมีคือ Na2C2O4 มีลักษณะเป็นผงผลึกสีขาว ไม่มีกลิ่น สลายตัวที่อุณหภูมิระหว่าง 250–270°C เตรียมได้จากปฏิกิริยาระหว่างกรดออกซาลิกกับโซเดียมไฮดรอกไซด์ที่อัตราส่วน 1:2 หรือสลายโซเดียมฟอร์เมตที่ความร้อนสูงกว่า 360°C
โซเดียมออกซาเลตใช้ในงานด้านไพโรเทคนิก โดยจะให้สีของไฟเป็นสีเหลือง[4] และใช้ในการไตเตรตสารละลายโพแทสเซียมเปอร์แมงกาเนต[5][6] ตามสมการ:[7]
- 5Na2C2O4 + 2KMnO4 + 8H2SO4 → K2SO4 + 5Na2SO4 + 2MnSO4 + 10CO2 + 8H2O
โซเดียมออกซาเลตมีความเป็นพิษเช่นเดียวกับสารกลุ่มออกซาเลตอื่น ๆ มีค่า LD50 ในผู้ใหญ่ประมาณ 10-30 กรัม (143-428 มิลลิกรัม/กิโลกรัม)[8] หากรับประทานเข้าไปจะทำให้เกิดอาการแสบร้อน อาเจียนเป็นเลือด ชัก ระบบหมุนเวียนโลหิตล้มเหลว[9] นอกจากนี้โซเดียมออกซาเลตยังมีคุณสมบัติในการดึงไอออนของแคลเซียมออกจากพลาสมาของเลือดและทำให้เลือดไม่จับตัวเป็นก้อน
อ้างอิง
[แก้]- ↑ 1.0 1.1 "ChemIDplus - 62-76-0 - ZNCPFRVNHGOPAG-UHFFFAOYSA-L - Disodium oxalate - Similar structures search, synonyms, formulas, resource links, and other chemical information". chem.nlm.nih.gov (ภาษาอังกฤษ). NIH. สืบค้นเมื่อ 7 January 2019.
- ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อyoshi - ↑ GHS: GESTIS 570199
- ↑ Jared Ledgard (1 พฤศจิกายน 2007). The Preparatory Manual of Black Powder and Pyrotechnics, Version 1.4. ISBN 978-0-615-17427-3.
- ↑ "Sodium oxalate (CAS 62-76-0)". Santa Cruz Biotechnology. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2016-04-05. สืบค้นเมื่อ 2016-07-27.
- ↑ Robert M. Fowler; Harry A. Bright (20 กันยายน 1935). "Standardization of permanganate solutions with sodium oxalate" (PDF). NIST (RP843).
- ↑ Mcbride, R. S. (1912). "The standardization of potassium permanganate solution by sodium oxalate". Journal of the American Chemical Society. 34: 393. doi:10.1021/ja02205a009.
- ↑ "Material Safety Data Sheet - Sodium oxalate" (PDF). Southwest Tennessee Community College. 15 กุมภาพันธ์ 2008.
- ↑ "Material Safety Data Sheet - Sodium Oxalate" (PDF). LabChem. 2 พฤศจิกายน 2009. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 15 มิถุนายน 2016. สืบค้นเมื่อ 27 กรกฎาคม 2016.
แหล่งข้อมูลอื่น
[แก้]- "Sodium oxalate - MSDS". Science Lab. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 24 มีนาคม 2017. สืบค้นเมื่อ 22 ตุลาคม 2016.
- "Disodium oxalate". ChemicalBook.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.

