ఆల్కీన్లు
వికీపీడియా నుండి


ఆల్కీన్లు అనేవి కార్బన్ - కార్బన్ మధ్య ద్విబంధాలతో తో వున్నహైడ్రో కార్బన్లు(R2C=CR2).ఇవి అసంతృప్త హైడ్రోకార్బన్లు అని పిలువబడతాయి, ఎందుకంటే అవి ఒకే సంఖ్యలో కార్బన్ పరమాణువులు కలిగిన ఆల్కేన్ కంటే తక్కువ హైడ్రోజన్ అణువులను కలిగి ఉంటాయి.డబుల్ బాండ్/ద్వి బంధం రెండు కార్బన్లచే పంచుకోబడుతుంది మరియు హైడ్రోజన్ అణువులను కలిగి ఉండదు.[1]ఆల్కీన్లు ఎంపిరికల్ అణు సూత్రం :CnH2n.ఆల్కీనులలో ఒకద్విబంధం మాత్రమే వుండును.అనగా ఒక ఆల్కీనుతో సమానమైన కార్బన్ పరమాణువులు వున్న ఆల్కేన్ కన్న రెండు హైడ్రోజన్ పరమాణువులను తక్కువగా కల్గి వుండును.ఉదహరణకు ఈథేన్ రెండు కార్బన్ పరమాణు వులు, ఆరు హైడ్రోజన్ పరమాణువులను కలిగి వుండగా,ఈథీన్ రెండు కార్బన్ పరమాణువులను, నాలుగు హైడ్రోజన్ పరమాణువులను కలిగివుండును.వాటిని కొన్నిసార్లు ఒలేఫిన్లు లేదా అసంతృప్త సమ్మేళనాలుగా అని కూడా పిలుస్తారు.[2]రసాయన పరిశ్రమలో ఆల్కీన్లు,అందులో ముఖ్యంగా ఈథీన్ చాలా ముఖ్యమైనది.అవి చాలా పెద్ద పరిమాణంలో ముడి చమురులో కనుగొనబడవు కానీ ఆల్కేన్ ల రసాయన విచ్చిన్నంద్వారా ఉత్పత్తి అవుతాయి. ఆల్కీన్లు అన్ని హైడ్రోకార్బన్ల వలె, గాలిలో మందడిపోయి కార్బన్ డయాక్సైడ్అలాగే నీటిని ఏర్పరుస్తాయి.ఆల్కీన్లు రసాయన పరిశ్రమలో ప్లాస్టిక్ల తయారీకి ,అనేక ఇతర రసాయనాలను ఇంధనంగా ఉపయోగించేందుకు ఉపయోగిస్తారు.[3]
ఆల్కీనుల నిర్మాణం
[మార్చు]ఆల్కీన్ sp2 హైబ్రిడైజ్డ్ దిబంధయుత కార్బన్ అణువులను కలిగి ఉంటుంది.σ-బంధం SP2 హైబ్రిడ్ ఆర్బిటాల్స్ అతివ్యాప్తి చెందడం ద్వారా ఏర్పడుతుంది, అయితే π- బంధం ఒక కార్బన్ పరమాణువు యొక్క హైబ్రిడైజ్ చేయని Pz కక్ష్య యొక్క పార్శ్వ అతివ్యాప్తి ద్వారా ఉత్పన్నమవుతుంది.π బంధం σ- బంధం కంటే బలహీనంగా ఉంటుంది.[4]
స్వాభావిక/సహజలభ్యత
[మార్చు]ఆల్కీన్లు ప్రకృతిలో విస్తృతంగా ఉన్నాయి. టెర్పెనెస్ రూపంలో ఆల్కీన్లు యొక్క ప్రధాన సహజ వనరు మొక్కలు.చాలా ముఖ్యమైన సహజ వర్ణద్రవ్యాలు టెర్పెనెస్లు. ఉదా లైకోపీన్ (టమోటాలలో ఎరుపు), కెరోటిన్ (క్యారెట్లలో నారింజ), మరియు శాంతోఫిల్స్ (గుడ్డు పచ్చసొనలో పసుపు).అన్ని ఆల్కీన్లలో సరళమైనది, ఇథిలీన్ అనేది మొక్కల పక్వాన్ని ప్రభావితం చేసే ఒక సిగ్నలింగ్/సంకేత అణువు.
- ప్రకృతిలో ఎంపిక చేయబడిన అసంతృప్త సమ్మేళనాలు
-
Limonene] a monoterpene.
-
Humulene, a sesquiterpene.
-
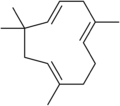
Taxadiene, a diterpene, precursor to the diterpenoid taxol], an anticancer agent.
-
Squalene, a triterpene and universal precursor to natural steroid]s.
ఆల్కీన్లు - ఐసోమరులు
[మార్చు]నాలుగు లేదా అంతకంటే ఎక్కువ కార్బన్ కలిగిన ఆల్కీన్లు స్థాన మరియు గొలుసు ఐసోమర్లను కలిగి ఉంటాయి. π- బంధం డబుల్ బాండ్ యొక్కస్వేచ్చా భ్రమణాన్ని నిరోధిస్తుంది కాబట్టి కార్బన్-కార్బన్ డబుల్ బాండ్ భ్రమణాన్ని నిరోధించడం జ్యామితీయ ఐసోమెరిజం యొక్క దృగ్విషయానికి దారితీస్తుంది.[4]ప్రత్యామ్నాయ ఆల్కీన్ రెండు రకాల స్టీరియో ఐసోమర్లను రెండు ఆల్కైల్ సమూహాలు ఒకే వైపు లేద్విబంధానికికి ఎదురుగా ఉన్న ప్రదేశాన్ని బట్టి ఇస్తుంది.రెండు సమూహాలు డబుల్ బాండ్ యొక్క ఒకే వైపున ఉన్నప్పుడు సిస్ (Cis) ఐసోమర్ పొందబడుతుంది, అయితే డబుల్ బాండ్కు ఎదురుగా ఉన్న ఆల్కైల్ సమూహం ట్రాన్స్(Trans0 ఐసోమర్ను ఇస్తుంది.[4]
-
సిస్-2 బూటేన్ యొక్క సౌష్టవం
-
ట్రాన్స్-2-బూటేన్ యొక్క సౌష్టవం
-
(E)-బూట్-2-ఎన్
-
(Z)-బూట్-2-ఏన్

ఆల్కీన్ల తయారీకి సాధారణ పద్ధతులు
[మార్చు]ఆల్కహాల్ నిర్జలీకరణం ద్వారా
[మార్చు]సమ్మేళనాల నుండి నీటి అణువును తొలగించడాన్ని డీహైడ్రేషన్/నిర్జలీకరణం అంటారుగాఢ సల్ఫ్యూరిక్ ఆమ్లం(H2SO4), పాస్పరిక్ ఆమ్లం(H3PO4), లేదా అల్యూమినియం ఆక్సైడ్(Al2O3) వంటి యాసిడ్ ఉత్ప్రేరకంతో ఆల్కహాల్ను వేడి చేసినప్పుడు ఆల్కీన్ లభిస్తుంది.అసమాన ఆల్కహాల్ తొలగింపు రెండు విధాలుగా కొనసాగుతుంది మరియు ఆల్కీన్ మిశ్రమం ఏర్పడుతుంది.[5]
ఆల్కైల్ హాలైడ్ యొక్క డీహైడ్రోహలోజెనేషన్
[మార్చు]ఆల్కైల్ హాలైడ్ ను ఆల్కహాలిక్ పొటాషియం హైడ్రాక్సైడ్ తో వేడీ చేయడం వల్ల ఆల్కీన్లు ఏర్పడుతుంది అలాగేఒక ఉప ఉత్పత్తిగా హైడ్రోజన్ హాలైడ్ లభిస్తుంది.[5]ఈ రసాయన చర్య కూడా Saytzeff నియమాన్ని అనుసరిస్తుంది.
వికినల్ డైహాలిడ్స్ యొక్క డీహలోజెనేషన్
[మార్చు]విసినల్ డైహలైడ్ను ఆల్కహాల్తో జింకు(Zn)పొడితో వేడి చేసినప్పుడు, ఆల్కీన్ లభిస్తుంది.విసినల్ డైహలైడ్ అనగా ప్రక్కనే ఉన్న కార్బన్ అణువులపై హాలోజన్ సమూహాన్ని కలిగి ఉన్న సమ్మేళనాలు.[5]
ఆల్కైన్ల నియంత్రిత హైడ్రోజనేషన్ ద్వారా
[మార్చు]ద్రవ ఆమోనియ (NH3)లో(సోడియం (Na) లేదాలిథియం (Li)తో లేదా లిండ్లార్ ఉత్ప్రేరకం సమక్షంలో హైడ్రోజన్తో ఆల్కైన్ల ప్రతిచర్యగా ఆల్కీన్ను ఇస్తుంది.[5]
ఆల్కేన్లను 500-800°0C వద్ద గాలి లేకుండా వేడి చేయడం వల్ల తక్కువ పరమాణుబరువు ఆల్కీన్, ఆల్కైన్ లు మరియు హైడ్రోజన్లు లభిస్తాయి.ఉత్ప్రేరకం సమక్షంలో రసాయన చర్య తక్కువ ఉష్ణోగ్రత వద్ద నిర్వహించబడుతుంది.[5]
ఆల్కీనుల యొక్క భౌతిక లక్షణాలు
[మార్చు]- ఆల్కీన్లు మూడు స్థితులలో(ఘన ,ద్రవ,వాయు) సహజంగా ఉంటాయి. మొదటి మూడు ఆల్కీన్లు వాయువులు మరియు తదుపరి పద్నాలుగు ఆల్కీనులు ద్రవాలు. వీటి కంటే ఎక్కువ ఆల్కెన్లు అన్నీ ఘనపదార్థాలు.[6]
- బలహీనమైన వాన్ డెర్ వాల్స్ బలగాల కారణంగా అన్ని ఆల్కీన్లు నీటిలో కరగవు.[6]
- కానీ ఆల్కీనులు బెంజీన్ లేదా అసిటోన్ వంటి సేంద్రీయ ద్రావకాలలో కరుగుతాయి ఎందుకంటే ఇక్కడ వాన్ డెర్ వాల్ శక్తులు కొత్త వాటితో భర్తీ చేయబడతాయిఆల్కీనులను పూర్తిగా కరిగేలా చేస్తాయి.[6]
- ఆల్కీన్లుల మరిగే బిందువులు వాటి పరమాణు నిర్మాణంపై ఆధారపడి ఉంటాయి. వాటి పరమాణు గొలుసు పొడవు పెరిగే కొలది వాటి మరుగు స్థానాలుపెరుగును . కాబట్టి అధిక ఆల్కీన్లు చాలా ఎక్కువ మరిగే బిందువులను(boiling point) కలిగి ఉంటాయి.[6]
కొన్ని ఆల్కీనుల పట్టిక
[మార్చు]కొన్నిరకాల ఆల్కీనులు వాటి అణుసుత్రాలు.ద్రవీభవన,మరుగు స్థానాలవివరాలు క్రింది పట్టికలో ఇవ్వడమైనది.[1]
| ఆల్కీన్ IUPAC పేరు | అణు సూత్రం | క్లుప్త సౌష్టవ సూత్రం | ద్రవీభవన ఉష్ణోగ్రత°C | మరుగు స్థానం°C |
| ఈథీన్ | C2H4 | CH2=CH2 | -169 | -104 |
| ప్రోపీన్ | C3H6 | CH2=CHCH3 | -185 | -47 |
| 1-బ్యూటీన్ | C4H8 | CH2=CHCH2CH3 | -185 | -6 |
| 1-పెంటీన్ | C5H10 | CH2=CH(CH2)2CH3 | -138 | 30 |
| 1-హెక్సీన్ | C6H12 | CH2=CH(CH2)3CH3 | -140 | 63 |
| 1-హెప్టిన్ | C7H14 | CH2=CH(CH2)4CH3 | -119 | 94 |
| 1-ఆక్టిన్ | C8H16 | CH2=CH(CH2)5CH3 | -102 | 121 |
రసాయన చర్యలు
[మార్చు]- ఓస్మియం టెట్రాక్సైడ్తో ఆల్కీన్లను ఆక్సీకరణ చెయ్యడం వలన వికినాల్ డయోల్స్ ఏర్పడును. దిగుబడిని ఇస్తుంది.[7]
- ఆల్కీన్లు చాలా రియాక్టివ్గా ఉంటాయి.ఇవి అదనపు ప్రతిచర్యలకు లోనవుతాయి.అవి అసంతృప్త కర్బన సమ్మేళనాలను ఏర్పరుస్తాయి.ఆల్కీన్లు హైడ్రోజన్తో చర్య జరిపి హైడ్రోజనేషన్కు గురవుతాయి.ఆల్కీన్లు హాలోజన్లతో చర్య జరిపి హాలోఅల్కీన్లను ఏర్పరుస్తాయి.ఆల్కీన్లు దీర్ఘ-గొలుసు పాలిమర్లను ఏర్పరుస్తాయి.ఆల్కీన్లు ఆక్సీకరణ ప్రతిచర్యలకు లోనవుతాయి.ఆల్కీన్లు ఐసోమైరైజేషన్కు లోనవుతాయి. ఇక్కడ ద్విబంధం యొక్క స్థానం అణువులో పునర్వ్యవస్థీకరించబడుతుంది.[8]
హైడ్రోబోరేషన్-ఆక్సీకరణ చర్య
[మార్చు]డైబోరేన్, ఆల్కీన్తో చర్య జరిపి ట్రయల్కైల్ బోరేన్ ని ఇస్తుంది. హైడ్రోజన్ పెరాక్సైడ్ తో ఆక్సీకరణపై ట్రయల్కైల్ బోరేన్ ఆల్కహాల్ను ఇస్తుంది.
దహన చర్య
[మార్చు]గాలిలో మందించినపుడు ఆల్కీన్లు కార్బన్ డయాక్సైడ్ అలాగే నీరు ఏర్పడును.అదే సమయంలొ ఉష్ణం వెలువడును.
- +3O2 → 2CO2+2H2O+ఉష్ణం
ఆల్కీన్లు అసంపూర్ణ దహనానికి గురవుతాయి. గాలిలో కాలిపోయినప్పుడు,ఆల్కీన్లు అసంపూర్ణ దహనానికి గురవుతాయి. అవి కార్బన్, కార్బన్ మోనాక్సైడ్, కార్బన్ డయాక్సైడ్, నీరు మరియు గాలిని ఏర్పరుస్తాయి.[9]
పొటాషియం పర్మాంగనేట్(KMnO4) తో ఆక్సికరణ చర్య
[మార్చు]ఆల్కలీన్ పొటాషియం పర్మాంగనేట్ (KMnO4)తో ఆల్కీన్ లు చర్య జరుపడం వలన గ్లైకాల్ ఏర్పడును.
హైడ్రోజన్ హాలైడ్లతో చర్య
[మార్చు]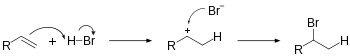
హైడ్రోజన్ బ్రోమైడ్ (HBr) మరియు హైడ్రోజన్ క్లోరైడ్(Hcl) వంటి హైడ్రోజన్ హాలైడ్లు, ఆల్కీన్లలో C=C ద్విబంధంవద్ద హాలోజెనోఅల్కైన్ను ఏర్పరుస్తాయి. ఇది హాలోజినేషన్ అని పిలువబడే ఎలెక్ట్రోఫిలిక్ అడిషన్ రియాక్షన్. ఇది గది ఉష్ణోగ్రత వద్ద జరుగుతుంది.హైడ్రోజన్ కంటే హాలోజన్లు ఎక్కువ ఎలెక్ట్రోనెగటివ్గా ఉన్నందున, H-X బంధం ధ్రువంగా ఉంటుంది మరియు హైడ్రోజన్ పరమాణువు పాక్షిక సానుకూల చార్జ్ను కలిగి ఉంటుంది. ఇది ఎలక్ట్రోఫైల్గా పనిచేయడానికి వీలు కల్పిస్తుంది.[9]
- H2C=CH2 + HBr → H3C−CH2Br
ఆల్కీన్ల హైడ్రేషన్ (నేరుగా నీటి చేరిక)
[మార్చు]బలమైన ఆమ్లం యొక్క ఉత్ప్రేరక సమక్షంలో ఆల్కీన్కు నీటిని కలపడం ఆల్కహాల్లు (హైడ్రాక్సీ-ఆల్కేన్స్) ఏర్పడును.[10]
- CH2=CH2+H2O→CH2CH2OH
ఆక్సీకరణ విచ్చెధన
[మార్చు]ఆల్కీన్లు లతో కూడిన మరొక ముఖ్యమైన రకమైన రసాయనచర్య ఆక్సీకరణ విచ్చెదన. అటువంటి చర్యలలో కార్బన్-కార్బన్ π-బంధం ఆక్సిడైజింగ్ ఏజెంట్ యొక్క చర్య ద్వారా పూర్తిగా విచ్ఛిన్నమవు తుంది, ఫలితంగా ఆల్డిహైడ్లు, కీటోన్లు మరియు కార్బాక్సిలిక్ యాసిడ్లు వంటి కార్బన్ యొక్క మరింత ఆక్సీకరణ రూపాలు ఏర్పడతాయి.[11]
అనువర్తనాలు
[మార్చు]ప్లాస్టిక్లు, మందులు మరియు ఇతర ఉపయోగకరమైన పదార్థాలను ఉత్పత్తి చేయడానికి అసంతృప్త హైడ్రోకార్బన్లు విస్తృతంగా ఉపయోగించబడతాయి.
| పేరు | నిర్మాణం | ఉపయోగం |
|---|---|---|
| Ethylene |  |
|
| 1,3-butadiene | 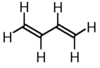 |
|
| vinyl chloride |
| |
| styrene | 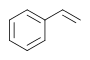 |
|
మూలాలు
[మార్చు]- ↑ 1.0 1.1 "Alkenes- Structures and Names". chem.libretexts.org. Retrieved 2024-05-03.
- ↑ "CHAPTER 3 ALKENES" (PDF). oit.edu. Retrieved 2024-05-03.
- ↑ "Alkene". byjus.com. Retrieved 2024-05-03.
- ↑ 4.0 4.1 4.2 "Alkenes Structure". scienceinfo.com. Retrieved 2024-05-03.
- ↑ 5.0 5.1 5.2 5.3 5.4 "alkenes". scienceinfo.com. Retrieved 2024-05-03.
- ↑ 6.0 6.1 6.2 6.3 "Physical Properties of Alkenes". toppr.com. Retrieved 2024-05-03.
- ↑ "Alkenes". sciencedirect.com. Retrieved 2024-05-03.
- ↑ "Chemical Properties of Alkenes". testbook.com. Retrieved 2024-05-03.
- ↑ 9.0 9.1 "Reactions of Alkenes". studysmarter.co.uk. Retrieved 2024-05-06.
- ↑ "Alkenes". cliffsnotes.com. Retrieved 2024-05-06.
- ↑ "Summary of Alkene Reactions". chem.libretexts.org. Retrieved 2024-05-06.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
![Taxadiene, a diterpene, precursor to the diterpenoid taxol], an anticancer agent.](https://upload.wikimedia.org/wikipedia/commons/thumb/d/d7/Taxadiene.svg/120px-Taxadiene.svg.png)





