2 වන ආවර්තයේ මූලද්රව්යය
2 වන ආවර්තයේ මූලද්රව්යයක් යනු, ආවර්තිතා වගුවෙහි දෙවන පේළියෙහි (හෝ ආවර්තයෙහි) පිහිටන රසායනික මූලද්රව්යයන් අතුරින් එකකි. ආවර්තිතා වගුව සකස් කර ඇත්තේ පේළි ලෙසින් වන අතර, එසේ කර ඇත්තේ මූලද්රව්යයන්ගේ පරමාණුක ක්රමාංකය වැඩිවත්ම, ඒවායේ රසායනික චර්යාවේ පුනරාවර්ත (ආවර්තිත) උපනතීන් සන්නිදර්ශනය කර දැක්වීමටය: රසායනික චර්යාවන් පුනරාවර්තනය වීම ඇරඹෙත්ම නව පේළියක් ඇරඹෙන අතර, සමතුල්ය චර්යාවන්ගෙන් යුතු මූලද්රව්යයන්ගෙන් සමන්විත වන තීරු තනයි.
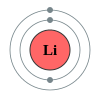
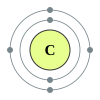
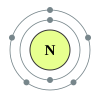
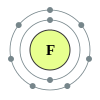
දෙවන ආවර්තයෙහි, ලිතියම්, බෙරිලියම්, බෝරෝන්, කාබන්, නයිට්රජන්, ඔක්සිජන්, ෆ්ලෝරීන් සහ, නියෝන් යන මූලද්රව්යයන් අඩංගු වෙති. මෙම සන්නිවේශය, පරමාණුක ව්යුහයෙහි නවීනතම සිද්ධාන්තයන් වෙතින් පැහැදිලි කල හැක. පරමානුක ව්යුහයෙහි ක්වොන්ටම් යාන්ත්ර විද්යාත්මක පැහැදිලි කිරීමක් අනුව, 2s සහ 2p කාක්ෂිකයන් පිරවීම හා සමගින්, මෙම ආවර්තය අනුරූප වෙයි. දෙවන ආවර්තයේ මූලද්රව්යයන් විසින් අෂ්ටක නීතිය පිළිපැදෙන්නේ, ඒවායේ සංයුජතා කවචය සම්පූර්ණ කිරීමට ඉලෙක්ට්රෝක අටක් අවශ්ය නිසාය. මෙම මූලද්රව්යයන් විසින් අවකාශ සැපයිය හැක්කේ උපරිම වශයෙන් ඉලෙක්ට්රෝන දහයකට පමණක් වන අතර, ඒවායින් දෙකක් 1s කාක්ෂිකයෙහි වන අතර, තවද දෙකක් 2s කාක්ෂිකයෙහිද සහ, තව සයක් 2p කාක්ෂිකයෙහි වෙති. බෙරිලියම් සහ නියෝන් හැර දෙවන ආවර්තයේ අන් සැම මූලද්රව්යයකටම ද්විපරමාණුක අණු තැනිය හැක.
ආවර්තිත උපනතීන්
[සංස්කරණය]
ආවර්තිත උපනතීන් උකහා ගැනීමට භාවිතා කල හැකි ආවර්තිතා වගුවෙහි පළමුවන ආවර්තය වන්නේ 2 වන ආවර්තය වෙයි. එය වෙතින් ආවර්තිත උපනතීන් උකහා ගැනීමට, මූලද්රව්යයන් දෙකක් (හයිඩ්රජන් සහ හීලියම්) පමණක් අඩංගු 1 වන ආවර්තය, කුඩා වැඩි වන්නේ, විශේෂයෙන්ම එම මූලද්රව්යයන් දෙක කිසිසේත්ම අනෙකුත් s-කාණ්ඩ මූලද්රව්යයන් ලෙසින් නොහැසිරෙන බැවිනි.[1][2] වඩාත් නිශ්චිත චර්යාවන් 2 වන ආවර්තය තුලින් හමුවෙයි. 2 වන ආවර්තයේ සියළුම මූලද්රව්යයන් සඳහා, පරමාණුක ක්රමාංකය ඉහළ යත්ම, මූලද්රව්යයන්ගේ පරමාණුක අරය අඩුවන අතර, විද්යුත් සෘණතාව ඉහළ යමින්, අයනීකරණ ශක්තිය ඉහළ යයි.[3]
2 වන ආවර්තයේ ඇත්තේ ලෝහ දෙකක් (ලිතියම් සහ බෙරිලියම්) පමණක් වන අතර, එනිසාම එය අඩුවෙන්ම ලෝහමය ආවර්තය බවට (1 වන ආවර්තය තුල ලෝහ නැති මුත්, ඉහත සඳහන් කල පරිදී, එය තුල ඇත්තේ මූලද්රව්ය දෙකක් පමණක් වන අතර, එබැවින් වැඩිපුර ලෝහ සහිත විය නොහැක) පත්කෙරෙන අතර, වැඩියෙන්ම අලෝහ සහිත ආවර්තය බවට පත් කෙරෙනුයේ, අලෝහ සතරක් සහිත නිසාය. 2 වන ආවර්තයේ මූලද්රව්ය වෙත, බොහෝවිට, ඒවායේ අදාළ කාණ්ඩවල වඩාත් අත්යන්ත ගුණාංග සහිත වෙයි; නිදසුනක් ලෙසින්, ෆ්ලෝරීන් යනු වඩාත් ප්රතික්රීයක හැලජනය වන අතර, නියෝන් යනු වඩාත් නිෂ්ක්රීය උච්ච වායුව වන අතර, ලිතියම් යනු අඩුතම ප්රතික්රීයක ක්ෂාර ලෝහය වෙයි.[4]
2 වන ආවර්තයේ සියළු මූලද්රව්ය මාඩලුං නීතිය සම්පූර්ණයෙන් පිලිපදිති; 2 වනආවර්තය තුල, ලිතියම් සහ බෙරිලියම් විසින් 2s උපකවචය පුරවනු ලබන අතර, බෝරෝන්, කාබන්, නයිට්රජන්, ඔක්සිජන්, ෆ්ලෝරීන් සහ, නියෝන් විසින් 2p උපකවචය පුරවනු ලැබේ. මෙම ආවර්තය විසින් මෙම විශේෂ ලක්ෂණය, 1 වන සහ ආවර්තය සහ 3 වන ආවර්ත සමග භුක්තිවිඳින අතර, මේ කිසිවක් සතුව, මෙම නීතියෙන් බැහැර වන අන්තරික මූලද්රව්ය හෝ අන්තර් අන්තරික මූලද්රව්ය අඩංගු නොවෙති.[4]
මූලද්රව්ය
[සංස්කරණය]රසායනික මූලද්රව්යය රසායනික ශ්රේණිය ඉලෙක්ට්රෝන වින්යාසය 3 Li ලිතියම් ක්ෂාර ලෝහය [He] 2s1 4 Be බෙරිලියම් ක්ෂාරීය පාංශු ලෝහය [He] 2s2 5 B බෝරෝන් ලෝහාලෝහය [He] 2s2 2p1 6 C කාබන් බහුපරමාණුක අලෝහය [He] 2s2 2p2 7 N නයිට්රජන් ද්විපරමාණුක අලෝහය [He] 2s2 2p3 8 O ඔක්සිජන් ද්විපරමාණුක අලෝහය [He] 2s2 2p4 9 F ෆ්ලෝරීන් ද්විපරමාණුක අලෝහය [He] 2s2 2p5 10 Ne නියෝන් උච්ච වායුව [He] 2s2 2p6
ආශ්රිත
[සංස්කරණය]- ^ මයිකල් ලෙයිං (2006). "වෙයාර් ටු පුට් හයිඩ්රජන් ඉන් අ පීරියඩික් ටේබල්?". ෆවුන්ඩේෂන්ස් ඔෆ් කෙමිස්ට්රි. 9 (2): 127. doi:10.1007/s10698-006-9027-5.
- ^ "ඉන්ටර්නැෂනල් යූනියන් ඔෆ් පියෝ ඇන්ඩ් ඇප්ලයිඩ් කෙමිස්ට්රි > පීරියඩික් ටේබල් ඔෆ් දි එලිමන්ට්ස්". IUPAC. සම්ප්රවේශය 2011-05-01.
- ^ මාස්ටර්සන්, විලියම්; හර්ලි, සිසිල් (2009). කෙමිස්ට්රි: ප්රින්සිපල්ස් ඇන්ඩ් රියැක්ෂන්ස් (සයවන ed.). බෙල්මාට්, කැලිෆෝර්නියා: බෲක්ස්/කෝල් සෙන්ගේජ් ලර්නිං. pp. 24–42. ISBN 978-0-495-12671-3.
((cite book)): Cite has empty unknown parameter:|coauthors=(help) - ^ a b ග්රේ, තියඩෝර් (2009). දි එලිමන්ට්ස්: අ විෂුවල් එක්ස්ප්ලොරේෂන් ඔෆ් එව්රි නෝන් ඇටම් ඉන් ද යුනිවර්ස්. නිව්යෝර්ක්: බ්ලැක් ඩෝග් ඇන්ඩ් ලෙවන්තල් ප්රකාශකයෝ. ISBN 978-1-57912-814-2.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.