Хлораты
Материал из Википедии — свободной энциклопедии
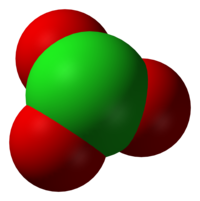
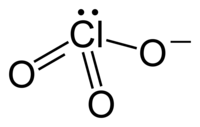
Хлора́ты — группа химических соединений, соли хлорноватой кислоты HClO3 или один из видов оксосолей хлора. Хлорат анион имеет структуру тригональной пирамиды (dCl—О = 0,1452—0,1507 нм, угол OClO = 106°). Анион ClO3− не образует ковалентных связей через атом О и не склонен образовывать координационные связи.
Свойства
[править | править код]Обычно хлораты — кристаллические вещества, растворимые в воде и некоторых полярных органических растворителях. В твёрдом состоянии при комнатной температуре довольно стабильны. При нагреве или в присутствии катализатора разлагаются с выделением кислорода. С горючими веществами могут образовывать взрывчатые смеси.
Хлораты являются сильными окислителями как в растворе, так и в твёрдом состоянии: смеси безводных хлоратов с серой, углём и другими восстановителями способны взрываться при быстром нагревании и ударе. Хотя хлор в хлоратах находится не в высшей степени окисления, доокислить его в водном растворе удаётся только электрохимически или под действием XeF2.
Хлораты большинства металлов получены в виде гидратов, в безводном состоянии выделены хлораты щелочных и щёлочноземельных металлов, Ag, Tl(II), Pb(II), а также NH4ClO3, N(CH3)4ClO3. Хлораты металлов переменной валентности обычно неустойчивы и склонны к взрывному распаду. Все хлораты щелочных металлов разлагаются с выделением большого количества тепла на соответствующие хлориды и кислород с промежуточным образованием перхлоратов.
Получение
[править | править код]- Хлорирование гидроксидов металлов:
- Обменные реакции хлоратов с другими солями
- Электрохимическое окисление хлоридов металлов в водных растворах
Применение
[править | править код]- В составе взрывчатых веществ
- В зажигательных смесях
- Для химического травления металлов
- Для получения кислорода в лабораторных масштабах
- Как десиканты для предуборочного высушивания растений
Биологическое действие
[править | править код]Хлораты являются токсичными веществами: они взаимодействуют с гемоглобином и переводят его в метгемоглобин, что приводит к распаду эритроцитов. Токсичная доза для человека составляет менее 1 г на 1 кг массы, а 10 г могут стать причиной смерти.
Примеры
[править | править код]Литература
[править | править код]- Химическая энциклопедия / Редкол.: Зефиров Н. С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5 (Три — Ятр). — 783 с. — ISBN 5-85270-310-9.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.

