Имины
Материал из Википедии — свободной энциклопедии

Имины — органические соединения общей формулы R1R2C=NR3, где R1, R2 — H, Alk, Ar и R3 — H, Alk, Ar, содержащие фрагмент NR3, соединенный двойной связью с атомом углерода. Представляют собой азотистые аналоги альдегидов (если R2 — H, это альдимины) и кетонов (когда R1, R2 — Alk, Ar, это кетимины).
К иминам относятся также азометины (основания Шиффа).
В систематической номенклатуре IUPAC суффикс -имин используется для обозначения только соединений, содержащих иминогруппу (т.е., в которых R3 — H)[1].
Свойства
[править | править код]Имины - маслообразные или кристаллические вещества, обычно нерастворимые в воде и растворимые в органических растворителях.
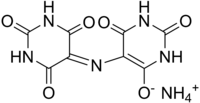
Несопряженные имины бесцветны, при сопряжении аминогруппы с ароматической системой или системой двойных связей - окрашены и используются в качестве красителей (азометиновые красители) и индикаторов, например, мурексид:
Характеристическая полоса иминогруппы в ИК-спектрах алифатических иминов лежит в области 1690-1640 см−1, у ароматических (N-бензилиденанилинов) - в области 1631-1613 см−1.
Реакционная способность
[править | править код]Атом азота в иминах слабонуклеофилен, атом углерода - электрофилен.
Имины обладают слабоосновными свойствами и в отсутствие воды могут протонироваться и алкилироваться по атому азота с образованием иминиевых солей:
- R2C=NR1 + R2Hal R2C=N+R1R2•Hal−
Иминиевые соли также образуются при алкилировании и ацилировании иминов, продукты алкилирования могут быть выделены, в случае ацилирования промежуточно образующиеся ацилиминиевые соли циклизуются в β-лактамы (азетидин-2-оны)
Реакции иминов с нуклеофилами протекают по атому углерода, весьма разнообразны и широко используются в органическом синтезе.
Так, имины гидролизуются водой с образованием карбонильных соединений и аминов, эта реакция обратна реакции синтеза иминов:
- R2C=NR1 + H2O R2C=O + R1NH2
Реакции иминов с аминами приводят к образованию аминалей (гем-диаминов):
- R2C=NR1 + R1NH2 R2C(NR1)2
Реакция иминов с цианистым водородом либо триметилсилилцианидом является вариантом реакции Штреккера и, в случае N-замещенных иминов, может служить методом синтеза N-замещенных α-аминокислот:
- R2C=NR1 + HCN R2C(NHR1)CN
- R2C(NHR1)CN + 2H2O R2C(NHR1)COOH + NH3
Взаимодействие реактивов Гриньяра и литийорганических соединений с иминами ведет к C-алкилированию последних с образованием аминов:
- R2C=NR1 + R2Li R2R2CN− R1 Li+
- R2R2CN− R1 Li+ + H2O R2R2CNHR1 + LiOH
Имины вступают в различные реакции циклоприсоединения, образуя с карбенами продукты (2+1)-циклоприсоединения - азиридины, с кетенами идет (2+2)-циклоприсоединение с образованием азетидин-2-оны (синтез β-лактамов по Штаудингеру, формально - ацилирования иминов кетенами):
С 1,3-диполярными соединениями (диазометаном, нитрилоксидами) образуются пятичленные гетероциклы - продукты (2+3)-циклоприсоединения.
Имины также могут выступать в роли диенофилов в реакции Дильса-Альдера[2]:
Под действием энергичных восстановителей (алюмогидрид лития, борогидрид натрия, водород над никелем Ренея и т. п.) имины восстанавливаются до вторичных аминов:
- R2C=NR1 + [H] R2CH-NHR1
Имины, образованные из енолизирующихся карбонильных соединений, способны к имин-енаминной таутомерии:
Синтез
[править | править код]Традиционным методом синтеза иминов является конденсация альдегидов и кетонов с первичными аминами. На первой стадии происходит нуклеофильная атака аминогруппы по электрофильному карбонильному атому углерода с образованием неустойчивого гем-аминоспирта, который далее дегидратируется до имина:
В случае альдегидов, несущих сильные электронакцепторные заместители при альдегидной группе (хлораль, гексафторацетон и т. п.), образуются стабильные гем-аминоспирты.
Имины также могут быть синтезированы окислением вторичных аминов надкислотами:
- R2CH-NHR1 + [O] R2C=NR1 + H2O
или через образование N-хлораминов с дальнейшим отщеплением от них хлороводорода:
- R2CH-NClR1 + OH− R2C=NR1 + H2O + Cl−
Специфическим методом синтеза α-оксоиминов является термическое разложение в инертном растворителе α-азидокетонов, получаемых взаимодействием α-галогенкетонов с азидом натрия[3]:
- RCOCH2Hal + NaN3 RCOCH2N3 + NaHal
- RCOCH2N3 RCOCH=NH + N2
Аналогичным образом происходит разложение функционализированных α-азидокетонов под действием аминов, в этом случае реакция сопровождается конденсацией амина с карбонильным фрагментом, что ведет к образованию 1,2-дииминов, таутомеризующихся далее в γ-имино-β-енамины[4]:
- RCOCH(N3)CH2COOEt + R'NH2 RC(=NR')C(=NH)CH2COOEt
- RC(=NR')C(=NH)CH2COOEt RC(=NR')C(NH2)=CHCOOEt
Примечания
[править | править код]- ↑ imines // IUPAC Gold Book. Дата обращения: 20 августа 2010. Архивировано 24 декабря 2013 года.
- ↑ Heintzelman, G. R.; Meigh, I. R.; Mahajan, Y. R.; Weinreb, S. M. Org. React. 2005, 65, 141. doi: (10.1002/0471264180.or065.02)
- ↑ Boyer, J. H.; Straw, D. Azidocarbonyl Compounds. II. The Pyrolysis of α-Azidocarbonyl Compounds1a (англ.) // Journal of the American Chemical Society[англ.] : journal. — 1953. — 1 April (vol. 75, no. 7). — P. 1642—1644. — ISSN 0002-7863. — doi:10.1021/ja01103a036.
- ↑ Mangelinckx, Sven; Van Vooren, Pieter; De Clerck, David; Fülöp, Ferenc; De Kimpea, Norbert. An efficient synthesis of γ-imino-and γ-amino-β-enamino esters (англ.) // Arkivoc : journal. — 2006. — Vol. 3. — P. 202—209. Архивировано 9 сентября 2017 года.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.