Sulfóxido

Um sulfóxido é um composto de estrutura R2S=O, em que R não é hidrogénio.[1] Estes compostos contém um grupo sulfinilo ligado a dois átomos de carbono; também pode ser considerados como tioéteres oxidados. Como exemplo, a aliina é um sulfóxido que pode encontrar na natureza (no alho).
Natureza do enlace
[editar | editar código-fonte]Os sulfóxidos costumam ser representados pela fórmula R-S(=O)-R'; onde R e R' são grupos orgânicos.[1] A ligação entre o enxofre e o oxigénio difere da ligação dupla convencional entre o carbono e o oxigénio (por exemplo, nas cetonas). A interacção enxofre-oxigénio tem um caracter electrostático, que produz um significante caracter dipolar, com o ónus negativo centrada no oxigénio.
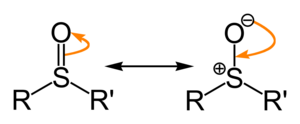
Um par de electrões livres reside no átomo de enxofre dando-lhe uma geometría molecular tetraédrica. Quando os grupos orgânicos são diferentes, o enxofre actua como um centro quiral (por exemplo no metilfenilsulfóxido).
A energia necessária para investir este centro é o suficiente alta como para converter aos sulfóxidos em opticamente estáveis. Isto é que o índice de racemização é baixo a temperatura ambiente. Os sulfóxidos quirais encontram utilidade em certas drogas como esomeprazole e Armodafinil, e também são empregues como auxiliares quirais.
Ver também
[editar | editar código-fonte]- Tioéteres - R-S-R'
- Sulfurilas - R-SO2-R'
Referências
- ↑ a b Victor Gold, IUPAC Gold Book, sulfoxides
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
