Destylacja z parą wodną
Destylacja z parą wodną – destylacja z użyciem strumienia nasyconej lub przegrzanej pary wodnej, prowadząca do otrzymywania kondensatów dwufazowych (faza wodna i organiczna), odbieranych w temperaturze niższej od temperatury wrzenia najniżej wrzącego składnika mieszaniny (heteroazeotrop).
Strumień pary wodnej jest doprowadzany do destylowanej mieszaniny z zewnątrz lub wytwarzany wewnątrz urządzenia do destylacji, na przykład przez intensywne ogrzewanie wodnego roztworu rozdzielanej mieszaniny związków chemicznych. Destylację z parą wodną stosuje się do wyodrębniania związków w niewielkim stopniu mieszających się z wodą (hydrofobowych), których destylacja prosta nie jest wskazana, głównie ze względu na możliwość termolizy. Metodą destylacji z parą wodną wyodrębnia się między innymi z surowców zielarskich pożądane składniki do leków ziołowych, a także olejków eterycznych (stosowanych do wytwarzania kosmetyków i przypraw oraz w aromaterapii).
Metoda ta jest również stosowana w preparatyce chemicznej do wyodrębniania produktów łatwo rozkładających się podczas syntezy z roztworów reakcyjnych oraz do rozdzielania składników mieszanin przy założeniu, że co najmniej jeden składnik destyluje z parą wodną[1][2][3][4].
Podstawy fizykochemiczne
[edytuj | edytuj kod]






Zgodnie z prawem Daltona całkowita prężność pary nad cieczą dwuskładnikową jest sumą cząstkowych prężności par składników:
które oblicza się na podstawie molowych udziałów obu składników w parze:
W przypadku roztworów doskonałych wartości i oblicza się na podstawie prawa Raoulta:
W przypadku roztworów niedoskonałych obserwowane są odchylenia od prawa Raoulta, których kierunek i wielkość zależą od wielkości sił oddziaływania między cząsteczkami A–A, B–B i A–B w cieczy (decydujących o wartościach współczynników aktywności). W przypadkach, gdy odchylenia od doskonałości są duże, w układach AB występują ekstremalne wartości prężności pary – maksymalne (azeotrop dodatni) lub minimalne (azeotrop ujemny). W przypadkach bardzo dużych odchyleń w układach występują obszary ograniczonej mieszalności cieczy (heteroazeotropia, heterozeotropia).
W przypadkach skrajnych dwie ciecze A i B, mieszające się w minimalnym stopniu, mogą być traktowane jak prawie niezależne układy ciecz–para. W każdym z nich w stałej temperaturze utrzymuje się taka sama prężność pary, niezależna od ilości obu cieczy. Ogrzewane w odrębnych naczyniach zaczynają wrzeć w różnych temperaturach – takich, w których prężności par są równe wartości ciśnienia zewnętrznego. Jeżeli niemieszające się ciecze A i B znajdują się w jednym naczyniu, zależność prężności pary każdej z nich od temperatury nie zmienia się, ale cząsteczki cieczy dwufazowej prędzej ją opuszczają. Wrzenie rozpoczyna się w niższej temperaturze – wtedy, gdy wartość ciśnienia zewnętrznego jest osiągana przez sumę prężności A i B.
W tak uproszczonym przypadku w stałej temperaturze skład pary nad roztworem jest niezależny od składu cieczy. Stosunek ilości moli A i B ( i ) w jednostce objętości pary jest równy stosunkowi odpowiednich prężności par ( i ) czystych składników w danej temperaturze. Stosunek mas obu składników ( i ) w parze jest zależny od prężności par czystych składników i ich ciężarów cząsteczkowych ( i ).
| Związek | Masa cząsteczkowa M [g/mol] |
twrzenia [°C] |
p [mmHg] w 100 °C |
Zawartość w destylacie % mas. |
| Karwon | 150 | 230 | 9 | 9,7 |
| Geraniol | 154 | 230 | 5 | 5,6 |
| Anetol | 148 | 235 | 8 | 7,1 |
| Eugenol | 164 | 250 | 2 | 1,7 |
| α-Santalol | 228 | 301 | < 1 | 0,5 |
Efektywność odzyskiwania wysokowrzących związków chemicznych z ich mieszanin ze związkami nielotnymi z parą wodną można zwiększyć, stosując destylację z użyciem pary przegrzanej. Warunkiem ograniczającym są prawdopodobne reakcje rozkładu termicznego.
Przykład
Benzaldehyd (tw. 178 °C przy 760 mmHg) destyluje z równowagową parą wodną (100 °C) w temperaturze 97,9 °C. Destylat zawiera 32,1% wag. benzaldehydu. Stosując parę wodną przegrzaną do 133 °C, otrzymuje się kondensat zawierający 70,6% wag. benzaldehydu[4].
Sprzęt do destylacji z parą wodną
[edytuj | edytuj kod]
Od lewej: wytwornica pary, kolba z substancją oczyszczaną, chłodnica, odbieralnik


(dla substancji o gęstości >1 g/cm³)
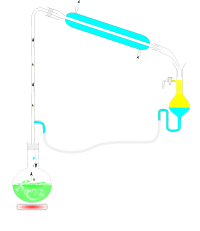
(dla substancji o gęstości <1 g/cm³)


Instalacje do destylacji z parą wodną, niezależnie od ich skali, składają się z następujących elementów[4]:
- wytwornicy pary, która bywa wyposażana w urządzenia do przegrzewania wylotowego strumienia lub zapobiegające porywaniu do destylatora kropel wody,
- zbiornik z materiałem zawierającym oddestylowywany związek chemiczny, na przykład mieszaninę produktów syntezy organicznej lub surowcem zielarskim, rozłożonym na rusztach (destylator),
- chłodnica (kondensator),
- rozdzielacz warstw dwufazowego kondensatu.
Standardowe zestawy laboratoryjne są montowane analogicznie do zestawów do destylacji prostej, z tym że kolba zamocowana jest pod kątem i nie musi być ogrzewana. Do kolby wprowadza się rurkę doprowadzającą strumień pary z centralnej sieci lub laboratoryjnej wytwornicy. Zamiast tradycyjnych korków z umieszczonymi rurkami, obecnie stosuje się specjalne szklane nasadki do destylacji z parą wodną. Tradycyjne metalowe kociołki, ogrzewane palnikami gazowymi, są wyposażone w poziomowskaz i wysoką rurkę, ograniczającą wahania ciśnienia i zapobiegającą wychlapywaniu wrzącej wody do strumienia pary. Po zakończeniu destylacji rurkę tę należy wysunąć ponad poziom cieczy lub usunąć z kociołka aby nie doszło do zassania cieczy z kolby do stygnącego kociołka. Jako wytwornice pary są też stosowane szklane kolby z elektrycznym płaszczem grzejnym również wyposażone w zabezpieczenie przed wahaniami ciśnienia.
Przebieg destylacji z parą wodną w laboratorium
[edytuj | edytuj kod]Strumień pary jest wprowadzany do kolby rurką sięgającą prawie do dna, często lekko zakrzywioną na końcu. Kolba jest montowana w takim położeniu, aby burzliwy przepływ pary przez ciecz nie powodował jej wychlapywania do chłodnicy.
Strumień pary niosącej oddestylowywane związki przepływa przez chłodnicę (wodną lub powietrzną), w której kondensują pary. Dwufazowy kondensat spływa do odbieralnika, którym może być np. standardowy rozdzielacz laboratoryjny albo urządzenia umożliwiające odbieranie obu faz w sposób ciągły, przez odpowiednio ulokowane rurki przelewowe.
Oddestylowany składnik mieszaniny poddawanej destylacji (na przykład produkt prowadzonej w kolbie reakcji) może częściowo rozpuszczać się w wodzie (lub mieszać się z nią) co generuje straty. Aby uniknąć strat i zwiększyć wydajność procesu, warstwę wodną można w sposób ciągły zawracać do kolby destylacyjnej/reakcyjnej. W takim przypadku kolba musi być dodatkowo ogrzewana.
Przykłady zastosowań
[edytuj | edytuj kod]
- Wyodrębnianie produktów syntez organicznych:
- Oddzielanie nieprzereagowanego aldehydu benzoesowego od kwasu cynamonowego, otrzymywanego w reakcji kondensacji tego aldehydu z bezwodnikiem octowym wobec octanu potasu (reakcja Perkina)[5][6]
- Oddzielenie głównego produktu jodowania benzenu (jodobenzenu) od produktów ubocznych[6][7]
- Oddzielanie aniliny, otrzymywanej przez redukcję nitrobenzenu, od nieprzereagowanego substratu[6][8]
- Rozdzielanie mieszaniny o-nitrofenolu i p-nitrofenolu, powstającej w czasie nitrowania fenolu[6][9].
- Różnica między prężnościami pary izomerów orto i para jest konsekwencją różnic w budowie cząsteczek. W przypadku izomeru orto tworzy się wewnątrzcząsteczkowe wiązanie wodorowe, które uniemożliwia asocjację cząsteczek. Asocjacji ulegają cząsteczki izomeru para, co powoduje zmniejszenie prężności pary.
- Ekstrakcja składników produktów naturalnych:
- Utarte w moździerzu goździki (Eugenia caryophyllata) umieszcza się wraz z wodą w kolbie do destylacji z parą wodną. Zebrany kondensat jest poddawany dwukrotnej ekstrakcji chlorkiem metylenu. Z oddzielonej warstwy organicznej odparowuje się rozpuszczalnik, otrzymując olejek goździkowy, którego głównym składnikiem jest eugenol[10].
Przypisy
[edytuj | edytuj kod]- ↑ Bolesław Bochwic (red. zespołowego tłumaczenia z jęz. niemieckiego (Autorenkolektiv, Organikum. Organisch–Chemisches Grundpraktikum, Berlin 1963)): Preparatyka organiczna. Wyd. 1. Warszawa: Państwowe Wydawnictwo Naukowe, 1969. (pol.).
- ↑ Romuald Klimek: Olejki eteryczne. Wyd. 1. Warszawa: Wydawnictwo Przemysłu Lekkiego i Spożywczego, 1957. (pol.).
- ↑ Stanisław Bursa: Chemia fizyczna. Wyd. 2 popr. Warszawa: Państwowe Wydawnictwo Naukowe, 1979. ISBN 83-01-00152-6. (pol.).
- ↑ a b c d Artur I. Vogel: Preparatyka organiczna. Wyd. 4. Warszawa: Wydawnictwa Naukowo-Techniczne, 1964, s. 13–17, 144–148, 1123. (pol.).
- ↑ Artur I. Vogel op. cit.: Preparatyka organiczna. s. 725–726.
- ↑ a b c d Magdalena Popławska, Laboratorium z chemii organicznej / Materiały Pomocnicze / Metody wydzielania i oczyszczania związków organicznych / Destylacja z parą wodną, Warszawa: Zakład Chemii Organicznej, Wydział Chemiczny PW [dostęp 2010-12-23] [zarchiwizowane z adresu 2009-03-20] (pol.).
- ↑ Artur I. Vogel, op. cit.: Preparatyka organiczna. s. 543, 547–548.
- ↑ Artur I. Vogel, op. cit.: Preparatyka organiczna. s. 573–574.
- ↑ Artur I. Vogel, op. cit.: Preparatyka organiczna. s. 689–690.
- ↑ Piotr Milart. I. Destylacja i ekstrakcja, 1.1. Olejek goździkowy, 1.2. Olejek anyżowy. „Ćwiczenia laboratoryjne z chemii organicznej dla studentów biofizyki, inżynierii materiałowej, biologii z geografią oraz biologii – kurs podstawowy (opracowanie na podstawie skryptu: A. Czarny, B. Kawałek, A. Kolasa, P. Milart, B. Rys, J. Wilamowski „Wprowadzenie do ćwiczeń laboratoryjnych z chemii organicznej”, Gdańsk 2005, oraz materiałów do ćwiczeń laboratoryjnych z chemii organicznej, ZChO Wydz. Chemii UJ)”, s. 14–22, Wersja poprawiona i rozszerzona 2006. Kraków: www.chemia.pk.edu.pl. [dostęp 2010-12-23]. (pol.).
Linki zewnętrzne
[edytuj | edytuj kod]- film z narracją ang. (1:38): Otrzymywanie olejku pomarańczowego w małej skali laboratoryjnej, lowlevelpanic999: Steam distillation. YouTube, 1 mar 2008. [dostęp 2010-12-31]. (ang.).
- film (1:37): Wyodrębnianie aldehydu benzoesowego, otrzymywanego metodą Perkina, gigogrozni: Steam distillation of benzaldehyde from raw cinnamic acid mixture (Perkin reaction). YouTube, 30 mar 2010. [dostęp 2010-12-31]. (ang.).
- film z narracją ang. (1:47), Destylacja olejku lawendowego (1:47), Lila Avery-Fuson, Paso Robles, Kalifornia; Filmmaker: Patrick Eaves: Lavender Guide: Distilling Lavender. YouTube, 29 wrz 2008. [dostęp 2010-12-31]. (ang.).
- film z napisami ang. (8:22): Wytwórnia olejków eterycznych, Sesha Sai: aromatic oil steam distillation plant. YouTube, 2009-12-23. [dostęp 2010-12-31]. (ang.).
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.

















