Aldehydy
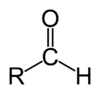
Aldehydy (łac. alcohol dehydrogenatus = „alkohol odwodorniony”[1]) – klasa organicznych związków chemicznych posiadających grupę aldehydową, czyli grupę karbonylową (C−O) połączoną z jednym (−CHO) lub dwoma (CH
2O) atomami wodoru. Proste aldehydy, będące pochodnymi alkanów i zawierające w cząsteczce jedną grupę aldehydową to alkanale o wzorze ogólnym C
nH
2n+1CHO.
Pokrewną klasę związków stanowią ketony (R
2CO), nieposiadające atomu wodoru przy grupie karbonylowej. Ketony i aldehydy mają zbliżone właściwości chemiczne, przy czym aldehydy są z reguły bardziej reaktywne. Istnieje też szereg reakcji charakterystycznych jedynie dla aldehydów.
Otrzymywanie
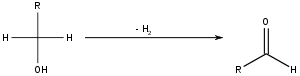
[edytuj | edytuj kod]Aldehydy otrzymuje się w przemyśle przez katalityczne odwodornienie pierwszorzędowych alkoholi:
Reakcję tę można też przeprowadzić stosując odpowiedni utleniacz, np. dichromian[2]:
- RCH
2OH + Cr
2O2−
7 → RCHO + Cr3+
Aby zapobiec utlenianiu powstającego aldehydu, należy usuwać produkt ze środowiska reakcji od razu po powstaniu. Do reakcji tej nie można zastosować nadmanganianu potasu, który jako silniejszy utleniacz prowadzi od razu do powstania soli kwasów karboksylowych[2].
Właściwości
[edytuj | edytuj kod]Aldehydy są charakterystycznie pachnącymi i toksycznymi związkami chemicznymi o własnościach grzybo- i bakteriobójczych – im krótszy łańcuch węglowy tym mniej przyjemny zapach i większa toksyczność. Formaldehyd i akroleina (przypalony tłuszcz) ma bardzo nieprzyjemny zapach, ale wanilina (waniliowy) czy cytronelal (cytrynowy) przyjemny. Aldehydy o krótkich łańcuchach węglowych dobrze rozpuszczają się w wodzie (np. aldehyd octowy CH
3CHO bez ograniczeń), w miarę zwiększania się ilości atomów węgla rozpuszczalność szybko spada. Aldehydy są to substancje będące w większości ciałami stałymi, wyjątkami są formaldehyd, acetaldehyd (aldehyd octowy) i aldehydy nienasycone – są gazami w miarę dobrze rozpuszczalnymi w wodzie.
Posiadają silne właściwości redukujące, czym różnią się od ketonów.
Charakterystyczne reakcje
[edytuj | edytuj kod]Najbardziej charakterystycznymi reakcjami dla aldehydów są
- reakcje addycji do grupy karbonylowej
- redukcja do alkoholi pierwszorzędowych:
- CH
3CHO + H
2 → C
2H
5OH
- CH
- utlenianie do kwasów karboksylowych:
- 2CH
3CHO + O
2 → 2CH
3COOH - reakcje tego typu są podstawą wykrywania i oznaczania aldehydów, m.in. za pomocą próby: Tollensa, Fehlinga, Benedicta czy Trommera, np.:
- próba Tollensa (tzw. próba lustra srebrowego):
- 2[Ag(NH
3)
2]+
+ HCHO + 3OH−
→ 2Ag↓ + HCOO−
+ 2H
2O + 4NH
3
- 2[Ag(NH
- próba Trommera:
- CH
3CH
2CHO + 2Cu(OH)
2 + OH−
→ CH
3CH
2COO−
+ Cu
2O↓ + 3H
2O
- CH
- 2CH
- odwracalna addycja wodorosiarczynu[3]:
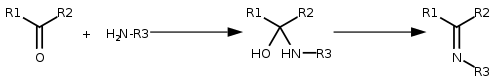
- addycja amoniaku lub amin, a następnie eliminacja wody, daje iminy:
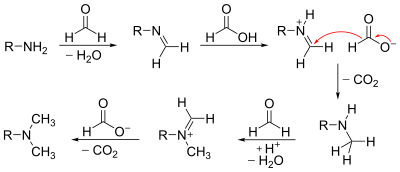
- Reakcja amin z formaldehydem w obecności kwasu (najczęściej kwasu mrówkowego) wykorzystywana jest do metylowania amin (reakcja Eschweilera-Clarke'a):
- kondensacja aldolowa (na przykładzie aldehydu octowego):
Według terminologii retrosyntetycznej aldehydy reprezentują synton akceptorowy typu a1, przy czym grupą funkcyjną jest grupa OH.
Zastosowanie
[edytuj | edytuj kod]Aldehydy stosowane są do syntez organicznych (tworzywa sztuczne, barwniki), w przemyśle spożywczym i kosmetycznym (składniki kompozycji zapachowych i aromatów spożywczych), garbarstwie (aldehyd glutarowy). Roztwór aldehydu mrówkowego (HCHO) w wodzie (tzw. formaliny) stosowany jest do konserwacji preparatów biologicznych.
Przykładowe aldehydy
[edytuj | edytuj kod]- benzaldehyd (aldehyd benzoesowy, PhCHO)
- formaldehyd (aldehyd mrówkowy, metanal, HCHO)
- acetaldehyd (aldehyd octowy, etanal, CH
3CHO) - akroleina (CH
2=CHCHO)
Zobacz też
[edytuj | edytuj kod]Przypisy
[edytuj | edytuj kod]- ↑ aldehyd, [w:] Słownik języka polskiego [online], Wydawnictwo Naukowe PWN [dostęp 2015-10-30].
- ↑ a b Robert Thornton Morrison, Robert Neilson Boyd, Chemia organiczna, t. 1, Warszawa: Państwowe Wydawnictwo Naukowe, 1985, s. 613–614, ISBN 83-01-04166-8, OCLC 749261996.
- ↑ a b Robert Thornton Morrison, Robert Neilson Boyd, Chemia organiczna, t. 1, Warszawa: Państwowe Wydawnictwo Naukowe, 1985, s. 731–732, ISBN 83-01-04166-8, OCLC 749261996.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.