Klorat
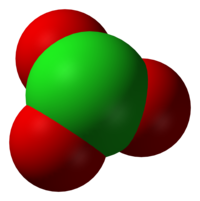
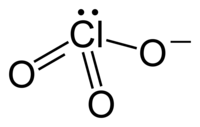
Klorat-ionet har den kjemiske formelen ClO3-. Klorat-ionet har en pyramideformet struktur. Klorat blir også brukt som fellesbetegnelse for kjemiske forbindelser som inneholder ett eller flere klorat-ioner, med klor i oksidasjonstilstanden +5. Klorater er salter
Framstilling
[rediger | rediger kilde]Metallklorater kan bli framstilt ved å tilsette klorgass til varme metallhydroksider, f.eks. kan kaliumklorat (KClO3) bli tilvirket slik:
- 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
I industriell skala blir natriumklorat () framstilt med basis i natriumklorid ( ) ved elektrolyse av en mettet vannoppløsning med natriumklorid som holder en temperatur på 40-60°C. En mere utførlig beskrivelse av produksjonsprosessen er forklart på siden for natriumklorat.
Egenskaper
[rediger | rediger kilde]Klorater er meget kraftige oksidasjonsmidler og må holdes adskilt fra organiske stoffer og lett oksiderbare stoffer. Enkelte klorater kan uten forvarsel eksplodere i kontakt med slike stoffer, spesielt med svovel og sulfider.
Bruksområder
[rediger | rediger kilde]Klorater ble tidligere benyttet i utstrakt grad i pyroteknikk, sprengstoff, fyrverkeri og fyrstikker. Bruken på disse områdene har imidlertid avtatt i senere tid på grunn av kloratenes ustabilitet, spesielt i blandinger med svovel og sulfider. I de fleste pyrotekniske innretningene er kloratene erstattet av perklorater (). Klorater blir også benyttet i ugressmidler og som blekemiddel i treforedlingsindustrien.
Noen kjente kloratforbindelser
[rediger | rediger kilde]- Ammoniumklorat (NH4ClO3)
- Bariumklorat (Ba(ClO3)2)
- Kaliumklorat (KaClO3)
- Kalsiumklorat (Ca(ClO3)2)
- Magnesiumklorat (Mg(ClO3)2)
- Natriumklorat (NaClO3)
- Sinkklorat (Zn(ClO3)2)
- Sølvklorat (AgClO3)
- Se også: Klorsyre
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.



