Fluorūdeņradis
| Fluorūdeņradis | |
|---|---|
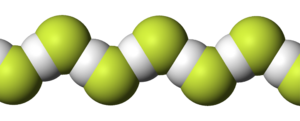 HF molekulu asociētā zigzagveida ķēde  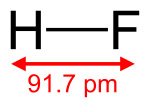 Molekulas uzbūve un attālums starp atomiem | |
| Citi nosaukumi | ūdeņraža fluorīds |
| Ķīmiskā formula | HF |
| Molmasa | 20,01 g/mol |
| Blīvums | 0,922 kg/m3 |
| Kušanas temperatūra | -83,4 °C |
| Viršanas temperatūra | 19,54 °C |
| Šķīdība ūdenī | jaucas jebkurās attiecībās[1] |
Fluorūdeņradis jeb ūdeņraža fluorīds (HF) ir bezkrāsains šķidrums ar asu smaku. Tas sāk vārīties jau pie 19,5 °C. Gaisā fluorūdeņradis stipri kūp. Ciets (sasalis) fluorūdeņradis ir ortorombiskas formas kristāli.
Iegūšana
[labot šo sadaļu | labot pirmkodu]Fluorūdeņradi parasti iegūst, iedarbojoties ar sērskābi uz kalcija fluorīdu (fluorītu):
- CaF2 + H2SO4 → 2HF + CaSO4
Tas rodas arī, ūdeņradim reaģējot ar fluoru (šī reakcija noris sprādzienveidā pat tumsā un zemās temperatūrās):
- Н2 + F2 → 2HF
Fiziskās īpašības
[labot šo sadaļu | labot pirmkodu]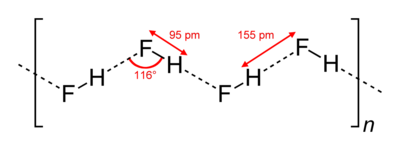
HF molekulas ir stipri polāras un starp tām ir novērojama izteikta ūdeņraža saite - šeit veidojas stabils fluorohidrogenāta jons HF2− un fluoronija jons FH2+ (tomēr šķidra HF pašjonizācija ir niecīga). Šķidrā fluorūdeņradī tā molekulas ar ūdeņraža saišu starpniecību savienojušās garās ķēdēs. Šīs ķēdes zināmā mērā saglabājas, vielai iztvaikojot - gāzes fāzē fluorūdeņradis sastāv no H2F2, H3F3,H4F4, H5F5 un H6F6 maisījuma un tikai 90 °C temperatūrā parādās atsevišķas HF molekulas. Šīs molekulas manāmi sāk disociēt atomos 3500 °C temperatūrā (tā ir augstāka par volframa kušanas temperatūru).
Fluorūdeņraža iztvaikošanas siltums viršanas temperatūrā ir tikai 7,5 kJ/mol, kas ir 6 reizes mazāk, nekā ūdenim tādā pašā temperatūrā (ap 20 °C). Tas izskaidrojams ar to, ka iztvaikošana maz maina HF molekulu asociāciju - tās pašas dimērās un polimērās formas saglabājas arī gāzes fāzē, atšķirībā no ūdens. Savukārt dielektriskā caurlaidība šķidram HF ir apmēram tāda pati kā ūdenim (84 pie 0 °C).
Ķīmiskās īpašības
[labot šo sadaļu | labot pirmkodu]Šķidrs HF ir šķīdinātājs ar stipri jonizējošām īpašībām, turklāt izšķīdinātās vielas tajā izturas kā bāzes (HF atdod tām protonus). Vienīgi perhlorskābe HClO4 fluorūdeņradī paliek kā skābe. Tajā labi šķīst nātrija, kālija un analoģisku I grupas elementu sāļi (fluorīdi, sulfāti, nitrāti), nedaudz vājāk — II grupas metālu savienojumi. Pat tāda stipra skābe kā slāpekļskābe šķidrā fluorūdeņradī izturas kā bāze — tajā tā veido nevis nitrātjonu NO3−, bet gan nitronija katjonu NO3H2+:
- HNO3 + 2HF ↔ NO3H2+ + HF2−
Savukārt etilspirts, kam ūdenī nav ne skābju, ne bāzu īpašību, fluorūdeņradī ir tikpat stipra bāze, kā KOH ūdenī:
- C2H5OH + 2HF ↔ [C2H5OH2]+ + HF2−
Šķīstot ūdenī, fluorūdeņradis veido vidēji stipru skābi, ko sauc par fluorūdeņražskābi:
- 2HF + H2O ↔ OH3+ + HF2−
Sauss fluorūdeņradis praktiski neiedarbojas ar vairumu no metāliem un to oksīdiem. Tomēr, ja reakcija ar metāla oksīdu ir sākusies, tā turpinās kā autokatalītisks process, jo reakcijā rodas ūdens:
- МeО + 2HF → MeF2 + Н2О
Izmantošana
[labot šo sadaļu | labot pirmkodu]Tīru fluorūdeņradi lieto organiskajām sintēzēm un fluorūdeņražskābes iegūšanai. Izmanto arī kriolīta iegūšanai, stikla kodināšanai, urāna heksafluorīda iegūšanai.
Fluorūdeņradis literatūrā
[labot šo sadaļu | labot pirmkodu]Pazīstamā krievu fantasta Ivana Jefremova zinātniski fantastiskajā stāstā "Čūskas sirds" aprakstīta hipotētiska dzīvība uz svešas planētas, kur skābekļa lomu izpilda fluors, bet planētas virsma klāta nevis ar ūdens, bet fluorūdeņraža okeānu. Rakstnieks savā darbā pamatojies uz lielo analoģiju starp ūdens un šķidra fluorūdeņraža īpašībām.
Atsauces
[labot šo sadaļu | labot pirmkodu]- ↑ N. Ahmetovs. Neorganiskā ķīmija. R:, "Zvaigzne", 1978, 281. lpp.
| Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Fluorūdeņradis |
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
