산화 알루미늄

| |

| |
| 식별자 | |
|---|---|
3D 모델 (JSmol)
|
|
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.014.265 |
| EC 번호 |
|
PubChem CID
|
|
| RTECS 번호 |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| Al2O3 | |
| 몰 질량 | 101.960 g·mol−1 |
| 겉보기 | white solid |
| 냄새 | odorless |
| 밀도 | 3.987g/cm3 |
| 녹는점 | 2,072 °C (3,762 °F; 2,345 K)[3] |
| 끓는점 | 2,977 °C (5,391 °F; 3,250 K)[4] |
| insoluble | |
| 용해도 | insoluble in 다이에틸 에터 practically insoluble in 에탄올 |
| log P | 0.31860[1] |
자화율 (χ)
|
−37.0×10−6 cm3/mol |
| 열전도율 | 30 W·m−1·K−1[2] |
굴절률 (nD)
|
nω=1.768–1.772 nε=1.760–1.763 Birefringence 0.008 |
| 구조 | |
| Trigonal, hR30, space group = R3c, No. 167 | |
격자 상수
|
a = 478.5 pm, c = 1299.1 pm
|
배위 기하 구조
|
octahedral |
| 열화학 | |
표준 몰 엔트로피 (S
|
50.92 J·mol−1·K−1[5] |
표준 생성 엔탈피 (ΔfH⦵298)
|
−1675.7 kJ/mol[5] |
| 약리학 | |
| D10AX04 (WHO) | |
| 위험 | |
| GHS 그림문자 | 
|
| NFPA 704 (파이어 다이아몬드) | |
| 인화점 | Non-flammable |
| NIOSH (미국 건강 노출 한계): | |
PEL (허용)
|
OSHA 15 mg/m3 (Total Dust) OSHA 5 mg/m3 (Respirable Fraction) ACGIH/TLV 10 mg/m3 |
REL (권장)
|
none[6] |
IDLH (직접적 위험)
|
N.D.[6] |
| 관련 화합물 | |
다른 음이온
|
aluminium hydroxide aluminium sulfide aluminium selenide |
다른 양이온
|
boron trioxide gallium oxide indium oxide thallium oxide |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
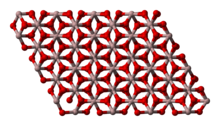

산화 알루미늄(Aluminium Oxide)은 화학식 Al2O3을 만족하는 양쪽성 산화물이다. 알루미나(Alumina), 알록사이트(Aloxite)라[7] 불리기도 한다.
생성
[편집]
- co2
- H2O
- 2 Al(OH)3 → Al2O3 + 3 H2O
전기분해를 이용한 정제
[편집]산화 알루미늄 분리
[편집]보크사이트(bauxite)는 산화 알루미늄(Al 2O3)과 산화철(Ⅲ)(Fe2O3), 실리카(silica)(SiO2)와 그 외 금속염 불순물이 섞여있는 혼합물이다. 전기 분해를 위해서는 산화 알루미늄만 분리해야 한다. 보크사이트에서 산화 알루미늄의 분리는 베이어 처리(Bayer process)를 이용한다. 이 처리 과정은 양쪽성의 산화 알루미늄이 강염기에 용해되는 반면, 산화철(Ⅲ) 및 다른 불순물은 용해되지 않는 원리에 기초한다. 보크사이트를 강염기인 수산화 나트륨(sodium hydroxide)(NaOH)에 녹이면, 다음과 같은 알짜 이온 반응식을 따른다.
- Al 2O3(s) + 2OH-(aq) +3H2O(l) → 2Al(OH)4-(aq)
수산화 이온(OH-)과 용해되지 않은 불순물을 거른 후, 거른 용액을 냉각시켜 과포화 상태를 만들어 재결정시키면 순수한 수화된 산화 알루미늄(Al 2O3·3H2O)이 침전한다.
- 2Al(OH)4-(aq) → Al 2O3·3H2O(s) + 2OH-(aq)
침전된 수화 산화 알루미늄을 1200°C에서 가열하면 수화된 물은 제거되고, 순수한 산화 알루미늄(Al2O3)을 얻을 수 있다.
산화 알루미늄 전기 분해
[편집]베이어 처리에 의해서 정제된 산화 알루미늄은 홀-에루 공정(Hall-Hḗroult process)에 의해서 전기 분해되어 순수한 알루미늄(Al)으로 정제된다. 미국의 찰스 홀과 프랑스의 폴 에루(Paul Hḗroult)가 21세의 나이 때 각각 독립적으로 개발한 공법이다. 이 공법은 빙정석(Na3AlF6)과 산화 알루미늄을 함께 녹여 전기 분해하는 원리를 갖는다. 빙정석은 산화 알루미늄에 대하여 매우 효과적인 용매인데, 순수한 빙정석의 경우 녹는점(Melting point)이 약 1000 °C인 것에 비해, 산화 알루미늄을 포함한 빙정석의 녹는점은 약 950 °C이다. 이 온도는 산화 알루미늄을 전기 분해하기 위해 액체로 녹여야 하는 온도인 2050 °C에 비해 매우 낮은 온도로써, 공업적으로 비교적 저렴한 비용으로 순수한 알루미늄을 정제해낼 수 있는 이점을 가졌다. 전기 분해가 일어나는 전기 분해 용기는 산화 반응이 일어나는 양극(산화극: anode)인 탄소봉과, 환원 반응이 일어나는 음극(환원극: cathode)인 탄소 코팅 철로 구성되어 있다. 이러한 용기를 이용하는 전기 분해의 전체 화학 반응식은 다음과 같다.
그러므로 산화극의 탄소봉은 반응이 진행됨에 따라 소모되므로 지속적인 전기 분해를 위해서는 정기적으로 교체해 주어야 한다.
각주
[편집]- ↑ “Aluminum oxide_msds”.
- ↑ Material Properties Data: Alumina (Aluminum Oxide) 보관됨 2010-04-01 - 웨이백 머신. Makeitfrom.com. Retrieved on 2013-04-17.
- ↑ Patnaik, P. (2002). 《Handbook of Inorganic Chemicals》. McGraw-Hill. ISBN 978-0-07-049439-8.
- ↑ Raymond C. Rowe; Paul J. Sheskey; Marian E. Quinn (2009). 〈Adipic acid〉. 《Handbook of Pharmaceutical Excipients》. Pharmaceutical Press. 11–12쪽. ISBN 978-0-85369-792-3.
- ↑ 가 나 Zumdahl, Steven S. (2009). 《Chemical Principles 6th Ed.》. Houghton Mifflin Company. ISBN 978-0-618-94690-7.
- ↑ 가 나 NIOSH Pocket Guide to Chemical Hazards. “#0021”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ "Aloxite" Archived 2007년 6월 25일 - 웨이백 머신, ChemIndustry.com database, retrieved 24 February 2007
같이 보기
[편집]외부 링크
[편집]Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.

