顕微鏡
 | |
| 用途 | 小標本の観察 |
|---|---|
| 著名な実験 | 細胞の発見 |
| 関連器具 | 光学顕微鏡 電子顕微鏡 |
顕微鏡(けんびきょう、英: microscope)は、肉眼で見るには小さすぎる物体を調べるために使われる実験器具である。古代ギリシャ語の μικρός(mikrós)「小さい」と σκοπέω(skopéō)「見る、検査する」に由来する。顕微鏡検査法(microscopy)は、顕微鏡を使用して小さな物体や構造を調べる科学をいう。微視的(microscopic)とは、顕微鏡の助けなしでは目に見えないことを意味する。
顕微鏡にはさまざまな種類があり、さまざまな視点から分類される。その一つは、装置が試料と相互作用して画像を生成する方法に着目するもので、光や電子のビームを光路内の試料に照射したり、試料から放出される光子や電子を検出したり、プローブを用いて試料表面の近傍を走査するなどがある。最も一般的な顕微鏡(そして最初に発明された顕微鏡)は光学顕微鏡で、薄く作成した試料を通過した可視光をレンズを使って屈折させ、観察可能な画像を生成する。その他の主な顕微鏡の種類には、蛍光顕微鏡、電子顕微鏡(透過型電子顕微鏡と走査型電子顕微鏡の両方)、各種の走査型プローブ顕微鏡がある[1]。
歴史

レンズのような器具の起源は4,000年前にさかのぼり、ギリシアで水を満たした球体の光学的特性に関する記述(紀元前5世紀)があるほか、その後、何世紀にもわたって光学に関する著作が残されている。単純な顕微鏡(拡大鏡)の最古の使用は、13世紀に眼鏡にレンズが広く使われたことにさかのぼる[2][3][4]。標本の近くに対物レンズを置き、接眼レンズで実像を観察する複式顕微鏡の最も初期の例は、1620年頃に、欧州で登場したことが知られている[5]。顕微鏡の発明者は、長年にわたって多くの主張がなされてきたにもかかわらず不明である。いくつかの説がオランダの眼鏡工房を中心に展開され、1590年にサハリアス・ヤンセン(彼の息子による主張)またはサハリアスの父ハンス・マルテンス、あるいはその両方によって発明されたという主張や[6][7]、隣人でライバルの眼鏡職人であったハンス・リッペルハイ(1608年に最初の望遠鏡で特許を申請)によって発明されたという主張のほか[8]、1619年にロンドンで改良版を持っていたと記されている移住者コルネリウス・ドレベルによって発明されたという主張などもある[9][10]。ガリレオ・ガリレイは(複式顕微鏡の発明者とされることもある)、1610年以降、望遠鏡の焦点を近づけて小さな物体を観察できることを発見し、1624年にローマで展示されたドレベルの複式顕微鏡を見た後、彼自身の改良版を作成したようである[11][12][13]。ジョバンニ・ファベールは、ガリレオが1625年にアッカデーミア・デイ・リンチェイに提出した複式顕微鏡を「microscope(顕微鏡)」と命名した(ガリレオはこれを「occhiolino(小さな目)」と呼んでいた)[14]。ルネ・デカルトは、1637年の著作「Dioptrique」で、対象物に向かってへこんだ凹面鏡をレンズと組み合わせ、対象物をその鏡の焦点に取り付けて照明するような顕微鏡について述べている[15]。
近代的な光学顕微鏡の進歩

顕微鏡の使用に基づく有機組織の顕微鏡解剖学に関する最初の詳細な記述は、ジョヴァンニ・バッティスタ・オディエルナの『L'occhio della mosca(ハエの目)』(1644年)に登場する[16]。
1660年代から1670年代にかけて、イタリア、オランダ、イギリスの博物学者たちが、生物学の研究で顕微鏡を使い始めるまで、顕微鏡はおおむね目新しいものであった。一部の生物学史家が組織学の父と呼ぶ、イタリアの科学者マルチェロ・マルピーギは、肺の研究から生物学的構造の分析を始めた。1665年に出版されたロバート・フックの『Micrographia(顕微鏡図譜)』は、その印象的な図版が大きな影響を引き起こした。フックは、ガラス糸の端を溶かした小さなガラス球から小さなレンズを作った[15]。
アントニ・ファン・レーウェンフックは、単純な単レンズ顕微鏡で300倍もの倍率を達成し、大きな貢献をもたらした。彼は、リベットで留めた2枚の金属板の穴の間に非常に小さなガラス球レンズを挟み、ネジで調整可能な針を取り付けて標本を固定した[17]。その後、ファン・レーウェンフックは赤血球(ヤン・スワンメルダムにちなむ)と精子を再発見し、生物の超微細構造を観察するための顕微鏡の普及に貢献した[16]。1676年10月9日、ファン・レーウェンフックは微生物の発見を報告した[18]。
複合光学顕微鏡の性能は、試料に光を集める集光レンズ系と、試料からの光をとらえて像を形成する対物レンズの品質、そして正しい使い方に依って決まる[5]。この原理が19世紀後半から20世紀初頭にかけて十分に理解され、開発され、また光源として電球が利用できるようになるまで、初期の器具には限界があった。1893年、アウグスト・ケーラーは、光学顕微鏡の理論的な分解能の限界を達成するための、中心的で重要な試料照明の原理であるケーラー照明を考案した。この試料照明法は均一な照明を実現し、初期の試料照明技術によって制約を受けていたコントラストと分解能の課題を克服した。試料照明のさらなる発展は、1953年のフリッツ・ゼルニケによる位相差の発見と、1955年のジョルジュ・ノマルスキーによる微分干渉コントラスト照明によるものである。どちらも、染色されていない透明な試料の画像化を可能にした。
電子顕微鏡

20世紀初頭、光学顕微鏡に代わる重要な装置が開発され、光の代わりに電子線を使って画像を生成する装置である。ドイツの物理学者エルンスト・ルスカは、電気技師マックス・クノールと共同で、1931年に最初のプロトタイプ電子顕微鏡である透過型電子顕微鏡(TEM)を開発した。透過型電子顕微鏡は光学顕微鏡と同様の原理で動作するが、光の代わりに電子を、ガラスレンズの代わりに電磁石を使用する。光の代わりに電子を使うことで、はるかに高い分解能が得られる。
透過型電子顕微鏡に追随してすぐ、1935年に、マックス・クノールによって走査型電子顕微鏡(SEM)が開発された[19]。しかし、TEMが第二次世界大戦前から研究に使われたのに対し、SEMの市販は1965年になってからである。
透過型電子顕微鏡は第二次世界大戦後に普及した。シーメンスに勤務していたエルンスト・ルスカが初の商業用の透過型電子顕微鏡を開発し、1950年代には電子顕微鏡に関する主要な科学会議が開催されるようになった。1965年、最初の商業用の走査型電子顕微鏡が、ケンブリッジ大学の教授チャールズ・オートリーと大学院生ゲイリー・スチュワートによって開発され、ケンブリッジ・インスツルメント・カンパニーから「Stereoscan(ステレオスキャン)」として販売された。
電子顕微鏡を使用した最新の発見の一つに、ウイルスを識別する能力があげられる[20]。この顕微鏡は小さな細胞小器官を目に見える鮮明な画像で映し出すため、電子顕微鏡ではウイルスや有害な細胞を観察するための試薬は必要なく、その結果、病原体をより効率的に検出することができる。
走査型プローブ顕微鏡

1981年から1983年まで、ゲルト・ビーニッヒとハインリッヒ・ローラーは、スイスのチューリッヒにあるIBM研究所で、量子トンネル現象の研究に従事していた。彼らは量子トンネル理論に基づき、プローブと試料表面の間で交わされる非常に小さな力を読み取る走査型プローブ顕微鏡(SPM)という実用的な装置を作り上げた。プローブが試料表面に非常に接近することで、電子がプローブと試料の間を連続的に流れ、試料表面からプローブへと電流が生じる。この顕微鏡は、基礎となる理論的説明が複雑であったことから、当初はあまり評判がよくなかった。1984年、ニュージャージー州マレーヒルにあるAT&Tのベル研究所に在籍していたジェリー・テルソフとD.R.ハーマンは、この装置で得られた実験結果と理論を結びつける論文を発表し始めた。その後、1985年には商業用の機器が開発され、1986年にはビーニッヒ、クエート、ガーバーが原子間力顕微鏡(AFM)を発明し、そしてビーニッヒとローラーのSPMに対するノーベル物理学賞受賞へと続いた[21]。
走査型プローブ顕微鏡では、超微細なプローブやチップを加工する技術が進歩するにつれて、新しいタイプの顕微鏡が開発され続けている。
蛍光顕微鏡

光学顕微鏡の最近の発展は、主に生物学における蛍光顕微鏡の進歩が中心となっている[22]。20世紀の最後の数十年間、特にポストゲノム時代には、細胞構造を蛍光染色するための多くの技術が開発された[22]。主な技術群には、特定の細胞構造を対象とした化学染色がある。たとえば、DNAを標識する化合物のDAPI、蛍光レポーターと結合した抗体の使用(免疫蛍光を参照)、緑色蛍光タンパク質などの蛍光タンパク質などがある[23]。これらの技術では、生存標本と固定標本のいずれにおいても、分子レベルでの細胞構造を分析するのに、さまざまな蛍光色素を使用する。
蛍光顕微鏡の進歩は、共焦点顕微鏡という近代的な顕微鏡設計の発展を促した。この原理は1957年にマービン・ミンスキーによって特許が取得されたが、この技術の実用化にはレーザー技術による制約があった。トーマス・クレーマーとクリストフ・クレーマーが初めて実用的な共焦点レーザー走査型顕微鏡を開発したのは1978年のことで、この技術は1980年代を通じて急速に普及した。
超解像顕微鏡
光学顕微鏡技術に関する(21世紀初頭)現在の研究の多くは、蛍光標識標本の超解像解析の開発に集中している[24]。構造化照明顕微鏡法(SIM)は分解能をおよそ2-4倍向上させることができ、誘導放出抑制顕微鏡(STED)のような技術は電子顕微鏡の分解能に近づいている[25][26]。その背景は、光または励起によって回折限界が生じるため、分解能の2倍で過飽和になってしまうことにある[27]。蛍光顕微鏡を単一分子の可視化に応用したシュテファン・ヘルは、エリック・ベツィグとウィリアム・モーナーとともに、STED技術の開発で2014年のノーベル化学賞を受賞した[28]。
X線顕微鏡
X線顕微鏡は、通常は軟X線帯域の電磁放射線を使用して物体を画像化する装置である。1970年代初頭のX線レンズ光学系の技術的な進歩により、この装置は現実的な画像生成の選択肢となった[29]。この技術は、化学的に固定されていない生体物質を含む物体の三次元画像を生成するために、トモグラフィでよく使用される(X線マイクロトモグラフィ参照)。現在、より透過力が強い硬X線用に光学系を改良するための研究が行われている[29]。
日本の顕微鏡の歴史
日本には、オランダから1750年頃に伝わったと考えられている[30]。1765年に後藤梨春(ごとうりしゅん)が著した「紅毛談(おらんだばなし)」に「虫目がね」として顕微鏡が紹介されている。1781(天明元)年には、小林規右衛門が日本最初の顕微鏡を作っている。この顕微鏡は、島津創業記念資料館が所蔵している。「雪の殿様」の異名を持つ土井利位は、顕微鏡により雪の結晶を観察し、様々な模様を残している。宇田川榕庵は、シーボルトから贈られた顕微鏡を持っており、様々な研究に役立てている。
日本で工業的に作られた最初の顕微鏡は、田中杢次郎が1907(明治40)年に作り上げた田中式600倍顕微鏡とされる。この顕微鏡は、当時の皇太子(後の大正天皇)へ献上された。また、1910年には、 加藤嘉吉と神藤新吉により、エムカテラが開発された。当時、日本が顕微鏡を数多く輸入していたのは、ツァイスやライツなどを擁するドイツであったが、第一次世界大戦の勃発により、ドイツからの輸入が途絶えたため、国産品が日本の市場を独占した。当初、国産品の品質は輸入品に及ばなかったが、昭和初期における陸海軍による要請を受け、顕微鏡を含めた本格的な光学機器が製造されるようになった[31]。
種類
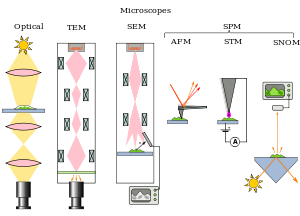

顕微鏡はいくつかの種類に分けることができる。そのひとつは、画像を生成するために試料と相互作用するもの、すなわち、光または光子(光学顕微鏡)、電子(電子顕微鏡)、プローブ(走査型プローブ顕微鏡)に基づく分類である。あるいは、走査点を介して試料を分析するか(共焦点光学顕微鏡、走査型電子顕微鏡、走査型プローブ顕微鏡)、試料を一度に分析するか(広視野光学顕微鏡、透過型電子顕微鏡)に基づいて分類することもできる。
広視野光学顕微鏡や透過型電子顕微鏡のどちらも、試料を透過した波や、試料で反射した波の通過によって生じる像を拡大するために、レンズの理論(光学顕微鏡では光学レンズ、電子顕微鏡では電磁レンズ)を利用している。使用される波は、電磁波(光学顕微鏡の場合)または電子線(電子顕微鏡の場合)である。これらの顕微鏡の分解能は、試料の画像化するために使用される放射線の波長によって制限され、波長が短いほど高い分解能が得られる[22]。
共焦点顕微鏡や走査型電子顕微鏡など、走査型の光学顕微鏡や電子顕微鏡の場合、レンズを使用して光または電子の点を試料上に収束させ、そのビームが試料と相互作用することによって生成した信号を分析する。したがって、その点を試料上で走査することで、矩形の領域を分析する。画像の拡大は、物理的に小さな標本領域を走査したデータを比較的大きな画面上に表示することで実現される。これらの顕微鏡の分解能には、広視野光学顕微鏡、プローブ顕微鏡、電子顕微鏡と同じく限界がある。
走査型プローブ顕微鏡もまた、試料中の一点を分析し、次に矩形の試料領域上でプローブを走査して画像を構築する。これらの顕微鏡は画像生成に電磁波や電子線を使用しないため、上記の光学顕微鏡や電子顕微鏡のような分解能の制限を受けることはない。
光学顕微鏡
最も一般的な顕微鏡、そして最初に発明された顕微鏡は光学顕微鏡である。これは、焦点面に置かれた試料の拡大像を生成する、1つまたは複数のレンズを持った光学機器である。光学顕微鏡には屈折ガラス(ときにはプラスチックや石英製)が使われ、光を眼に、あるいは別の光検出器に集める。ミラー結像式の光学顕微鏡も同じように動作する。光学顕微鏡の一般的な倍率は、可視域の光を想定した場合で、最大1,250倍、理論的な分解能の限界は約0.250マイクロメートル(250ナノメートル)である[22]。このため、実用的な倍率は最大1,500倍に制限される。特殊な技術によって、この倍率を超えることができるが(たとえば走査型共焦点顕微鏡、Vertico SMI)、分解能は回折限界である。紫外線のような短い波長の光の使用は、走査型近接場光学顕微鏡のような装置と同様、光学顕微鏡の空間分解能を向上させる一つの方法である。
Sarfusは最近の光学技術で、標準的な光学顕微鏡の感度を、ナノメートルフィルム(0.3ナノメートル厚保まで)や孤立したナノ物体(2ナノメートル径まで)を直接可視化できるレベルに向上させた。この技術は、交差偏光反射光顕微鏡用の無反射基板の使用に基づいている[33]。
紫外光は、微細な特徴の解像を可能にするだけでなく、目視では気付かないような標本の画像化も可能にする。近赤外光は、ケイ素がこの波長領域で透明であることを利用して、接合型シリコンデバイスに埋め込まれた回路を視覚化するために使われる。
蛍光顕微鏡法では、紫外線から可視光線までの多くの波長の光を利用して標本を蛍光させ、目視または特殊な感度のカメラで観察することができる。

位相差顕微鏡法は、透明な標本を通過する光のわずかな位相ずれを、画像の振幅やコントラストの変化に変換する光学顕微鏡照明技術である[22]。位相差顕微鏡の使用により、プレパラートを観察するための染色が不要になる。これによって、生きた細胞の細胞周期を研究できるようになった。
伝統的な光学顕微鏡は、最近になってデジタル顕微鏡へと進化した。接眼レンズを通して対象物を直接見ることに加えて、あるいはその代わりに、デジタルカメラに使用されているのと同様のセンサーで画像を取得し、それをコンピューターのモニターに表示する。これらのセンサーは、用途に応じてCMOSや電荷結合素子(CCD)などの技術が使われる。
高感度の光子計数デジタルカメラを使用することで、痛みやすい生体試料への損傷を避けるために、非常に光量を抑えたデジタル顕微鏡による検査が可能である。量子もつれ光子対を発生する光源により、最も光に敏感な試料の損傷リスクを最小限に抑えられることが実証されている。光子スパース顕微鏡へのゴーストイメージングの応用では、試料に赤外光子を照明し、それぞれの光子が可視帯域内のもつれパートナーと空間的に相関し、光子計数カメラにより効率的に画像化される[34]。

電子顕微鏡
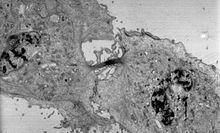
電子顕微鏡には大きく分けて、透過型電子顕微鏡(TEM)と走査型電子顕微鏡(SEM)の2種類がある[22][23]。どちらも高エネルギーの電子線を試料に集束させるための一連の電磁レンズと静電レンズを備えている。TEMでは、基本的な光学顕微鏡と同じように、電子は試料を透過する。電子はほとんどの物質で強く散乱されるため、試料を慎重に準備する必要がある[22][23]。また、電子が通過するためには、試料は非常に薄くなければならない(100 nm以下)[22][23]。オスミウムと重金属で染色した細胞の断面からは、膜系細胞小器官やリボソームなどのタンパク質がはっきりと見える[23]。0.1 nmレベルの分解能で、ウイルス(20-300 nm)やDNA鎖(幅2 nm)の詳細な画像を得ることができる[23]。一方、SEMは、微細な電子線でバルク物体の表面を走査するため、ラスターコイルを備えている。そのため、試料は必ずしも切片化する必要はないが、非導電性の試料に対してはナノメートル金属層や炭素層によるコーティングが必要になる場合がある[22]。SEMは、乾燥を防ぐために薄い水蒸気中で、試料の高速表面イメージングを可能にする[22][23]。
プローブ走査型
走査型プローブ顕微鏡の種類は、小さなプローブが試料上を走査し、試料と相互作用するときに生じるさまざまな種類の相互作用に基づいている。これらの相互作用または状態は、表面上の位置の関数として記録またはマッピングして、特性マップを作成できる。走査型プローブ顕微鏡の最も一般的な3つのタイプは、原子間力顕微鏡(AFM)、走査型近接場光学顕微鏡/SNOM(または、近接場走査型光学顕微鏡/NSOM)、走査型トンネル顕微鏡(STM)である[35]。原子間力顕微鏡は、シリコンまたは窒化シリコン製の微細なプローブがカンチレバーに取り付けられ、プローブは試料表面上を走査し、プローブと試料表面の相互作用を引き起こす力が測定され、マッピングされる。近接場走査型光学顕微鏡は、AFMに似ているが、そのプローブは通常、光が通過するための開口部のある先端で覆われた光ファイバー内の光源で構成されている。この顕微鏡は、透過光または反射光のいずれかを捕捉して、通常は生物学的な試料表面の非常に局所的な光学特性が測定される。走査型トンネル顕微鏡は、頂端原子が1つの金属チップを持ち、チップは電流が流れる管に取り付けられている[36]。トンネル電流が流れるまで導電性試料の表面上をチップが走査される。コンピュータ制御のチップの動きによって電流が一定に保たれ、記録されたチップの動きによって画像が形成される[35]。
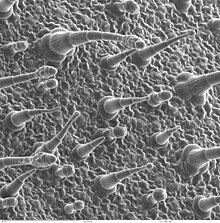
その他の種類
走査型音響顕微鏡は、音波を使って音響インピーダンスの変化を測定する。原理的にはソナーと同様で、集積回路に見られるような材料の表面下の欠陥を検出するなどの用途に使用される。2013年、オーストラリアの科学者らは、生きた細胞の内部構造を探る「量子顕微鏡」を製作した[37][38]。
モバイルアプリは、スマートフォンの内蔵カメラを顕微鏡として使うアプリケーションソフトウェアで、カメラを対象に近づけて撮影した画像を画面に拡大表示することで光学顕微鏡として使用できる。ただし、この顕微鏡は視覚的なノイズが多く、倍率は数10倍で、カメラレンズ自体の分解能にも限界がある。
参考項目
- 蛍光干渉コントラスト顕微鏡法 (Fluorescence interference contrast microscopy、FLIC) - ナノメートルスケールの分解能で表面構造を測定するための顕微鏡技術
- レーザーマイクロダイセクション法(Laser capture microdissection、LCM) - 顕微鏡下で生体組織から特定の細胞を分離する解剖技術
- 多焦点顕微鏡 (Multifocal plane microscopy、MUM) - 試料内の異なる焦点面を同時に撮像することで生細胞の3次元的動態を追跡できる光顕微鏡法
- 顕微鏡画像処理 - 顕微鏡から得た画像を処理、分析、表示するためのデジタル画像処理技術
- スライドガラス - 顕微鏡下で検査する対象物を保持するためのガラス板
- 英国王立顕微鏡学会 (RMS) - 顕微鏡の普及を目的とする世界最古の学術団体
脚注
- ^ Characterization and Analysis of Polymers. Hoboken, NJ: Wiley-Interscience. (2008). ISBN 978-0-470-23300-9
- ^ Bardell, David (May 2004). “The Invention of the Microscope”. BIOS 75 (2): 78–84. doi:10.1893/0005-3155(2004)75<78:tiotm>2.0.co;2. JSTOR 4608700.
- ^ The history of the telescope by Henry C. King, Harold Spencer Jones Publisher Courier Dover Publications, 2003, pp. 25–27 ISBN 0-486-43265-3, 978-0-486-43265-6
- ^ Atti Della Fondazione Giorgio Ronchi E Contributi Dell'Istituto Nazionale Di Ottica, Volume 30, La Fondazione-1975, p. 554
- ^ a b Murphy, Douglas B.; Davidson, Michael W. (2011). Fundamentals of light microscopy and electronic imaging (2nd ed.). Oxford: Wiley-Blackwell. ISBN 978-0-471-69214-0
- ^ Sir Norman Lockyer (1876). Nature Volume 14
- ^ Albert Van Helden; Sven Dupré; Rob van Gent (2010). The Origins of the Telescope. Amsterdam University Press. pp. 32–36, 43. ISBN 978-90-6984-615-6
- ^ “Who Invented the Microscope?”. Live Science (2013年9月14日). 2017年3月31日閲覧。
- ^ Eric Jorink (2010-10-25). Reading the Book of Nature in the Dutch Golden Age, 1575-1715. BRILL. ISBN 978-90-04-18671-2
- ^ William Rosenthal, Spectacles and Other Vision Aids: A History and Guide to Collecting, Norman Publishing, 1996, pp. 391–92
- ^ Raymond J. Seeger, Men of Physics: Galileo Galilei, His Life and His Works, Elsevier – 2016, p. 24
- ^ J. William Rosenthal, Spectacles and Other Vision Aids: A History and Guide to Collecting, Norman Publishing, 1996, page 391
- ^ uoregon.edu, Galileo Galilei (Excerpt from the Encyclopedia Britannica)
- ^ Gould, Stephen Jay (2000). “Chapter 2: The Sharp-Eyed Lynx, Outfoxed by Nature”. The Lying Stones of Marrakech: Penultimate Reflections in Natural History. New York: Harmony. ISBN 978-0-224-05044-9
- ^ a b Henker, Otto (1911). . In Chisholm, Hugh (ed.). Encyclopædia Britannica (英語). Vol. 18 (11th ed.). Cambridge University Press. p. 392.
- ^ a b Wootton, David (2006). Bad medicine: doctors doing harm since Hippocrates. Oxford [Oxfordshire]: Oxford University Press. p. 110. ISBN 978-0-19-280355-9[要ページ番号]
- ^ Liz Logan (2016年4月27日). “Early Microscopes Revealed a New World of Tiny Living Things”. Smithsonian.com. 2016年6月3日閲覧。
- ^ Douglas, Anderson. “Wrote Letter 18 of 1676-10-09 (AB 26) to Henry Oldenburg”. lensonleeuwenhoek.net. 2024年5月2日閲覧。
- ^ Knoll, Max (1935). “Aufladepotentiel und Sekundäremission elektronenbestrahlter Körper”. Zeitschrift für Technische Physik 16: 467–475.
- ^ Goldsmith, Cynthia S.; Miller, Sara E. (2009-10-01). “Modern Uses of Electron Microscopy for Detection of Viruses” (英語). Clinical Microbiology Reviews 22 (4): 552–563. doi:10.1128/cmr.00027-09. ISSN 0893-8512. PMC 2772359. PMID 19822888.
- ^ Morita, Seizo『Roadmap of Scanning Probe Microscopy』Springer-Verlag Berlin Heidelberg、Berlin, Heidelberg、2007年。doi:10.1007/978-3-540-34315-8。ISBN 978-3-540-34315-8。
- ^ a b c d e f g h i j Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (2000). “Microscopy and Cell Architecture” (英語). Molecular Cell Biology. 4th Edition.
- ^ a b c d e f g Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). “Looking at the Structure of Cells in the Microscope” (英語). Molecular Biology of the Cell. 4th Edition.
- ^ 堀田純一, 羽鳥晋由 (2021年9月号). “超解像蛍光顕微鏡法”. ぶんせき (日本分析化学会): 440-445.
- ^ “The Nobel Prize in Chemistry 2014 – Scientific Background”. www.nobelprize.org. 2018年3月20日時点のオリジナルよりアーカイブ。2018年3月20日閲覧。
- ^ 藤田, 克昌 (2018). “超解像顕微鏡の原理と展望”. 応用物理 87 (3): 164–170. doi:10.11470/oubutsu.87.3_164.
- ^ 藤田, 克昌「回折限界をどう超えるかー超解像蛍光イメージングー (回折限界を超えて)」『光学』第38巻第7号、日本光学会、2009年7月、p.334-343,巻頭1p、2024年5月1日閲覧。
- ^ “The Nobel Prize in Chemistry 2014”. www.nobelprize.org. 2018年3月20日閲覧。
- ^ a b Erko, A.『Modern developments in X-ray and neutron optics』Springer、Berlin、2008年。doi:10.1007/978-3-540-74561-7。ISBN 978-3-540-74561-7。
- ^ “顕微鏡の歴史 日本の顕微鏡の誕生と発展”. 日本顕微鏡工業会. 2021年8月1日閲覧。
- ^ “顕微鏡の歴史 国産顕微鏡の夜明け”. 日本顕微鏡工業会. 2021年8月1日閲覧。
- ^ Pennycook, S.J.; Varela, M.; Hetherington, C.J.D.; Kirkland, A.I. (2011). “Materials Advances through Aberration-Corrected Electron Microscopy”. MRS Bulletin 31: 36–43. doi:10.1557/mrs2006.4.
- ^ Ausserré, Dominique; Valignat, Marie-Pierre (2006-07-01). “Wide-Field Optical Imaging of Surface Nanostructures” (英語). Nano Letters 6 (7): 1384–1388. doi:10.1021/nl060353h. ISSN 1530-6984.
- ^ Aspden, Reuben S.; Gemmell, Nathan R.; Morris, Peter A.; Tasca, Daniel S.; Mertens, Lena; Tanner, Michael G.; Kirkwood, Robert A.; Ruggeri, Alessandro et al. (2015). “Photon-sparse microscopy: visible light imaging using infrared illumination”. Optica 2 (12): 1049. Bibcode: 2015Optic...2.1049A. doi:10.1364/OPTICA.2.001049. ISSN 2334-2536.
- ^ a b Bhushan, Bharat, ed (2010). Springer handbook of nanotechnology (3rd rev. & extended ed.). Berlin: Springer. p. 620. ISBN 978-3-642-02525-9
- ^ Sakurai, T.; Watanabe, Y., eds (2000). Advances in scanning probe microscopy. Berlin: Springer. ISBN 978-3-642-56949-4
- ^ “Quantum Microscope for Living Biology”. Science Daily (2013年2月4日). 2013年2月5日閲覧。
- ^ Taylor, Michael A.; Janousek, Jiri; Daria, Vincent; Knittel, Joachim; Hage, Boris; Bachor, Hans-A.; Bowen, Warwick P. (2013-03). “Biological measurement beyond the quantum limit” (英語). Nature Photonics 7 (3): 229–233. doi:10.1038/nphoton.2012.346. ISSN 1749-4893.
外部リンク
- FAQ on Optical Microscopes - 光学顕微鏡に関するよくある質問 (英語、2009年4月4日のアーカイブ)
- Nikon MicroscopyU, tutorials from Nikon - 光学顕微鏡に関する学生向けの解説記事 (英語)
- Molecular Expressions : Exploring the World of Optics and Microscopy, Florida State University. - 光学顕微鏡で撮影された顕微鏡写真のギャラリー (英語)
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
