水素化
水素化(すいそか、英: hydrogenation)とは、水素ガスを還元剤として化合物に対して水素原子を付加する還元反応のことである。水素添加反応(すいそてんかはんのう)、略して水添(すいてん)と呼ばれることもある。この反応は触媒を必要とするため、接触水素化(せっしょくすいそか、catalytic hydrogenation)とも呼ばれる。文脈によっては水素化反応を使用した実験手法・技術のことを指す場合もある。
より広義には還元剤が何であるかを問わず、化合物に水素原子を付加する還元反応全般のことを指す場合もある。
歴史
[編集]接触水素化反応は1897年にポール・サバティエによって発見された。サバティエは水素ガス中で酸化物を還元して調製した微細なニッケル粉末が、エチレンへの水素の付加反応の触媒となることを発見した。この発見によりサバティエは1912年にノーベル化学賞を受賞した。
その後、白金族元素、中でもルテニウム、ロジウム、パラジウム、白金の4元素が強い触媒活性を持つことが発見された。ニッケルを含めたこれらの元素が水素化反応には良く用いられている。
1966年にジェフリー・ウィルキンソンは前年に自身が発見したロジウムトリス(トリフェニルホスフィン)クロリド(ウィルキンソン触媒)が水素ガス中でアルケンを水素化する触媒となることを発見した。この高活性な触媒の発見から反応溶液に可溶な触媒を用いる均一系水素化反応が発展していくことになる。
不斉水素化反応は1956年に赤堀四郎、泉美治によりパラジウムをキラルな担体である絹に固定した触媒において初めて発見された。均一系触媒においては1968年にウィリアム・ノールズらによりキラルホスフィン配位子を持つロジウム錯体で発見された。1971年にはアンリ・カガンらによりDIOPを配位子とするロジウム錯体でα,β-不飽和アミノ酸を水素化すると、高いエナンチオ選択性が見られることが発見された。
1980年に野依良治らはBINAP配位子を持つ錯体は広い基質に対して高いエナンチオ選択性が見られることを発見した。この業績によりウィリアム・ノールズと野依良治は2001年のノーベル化学賞を受賞した。
不均一系触媒による接触水素化
[編集]不均一系触媒における水素化は触媒によって選択性が大きく異なるため、目的とする反応に応じて適切な触媒が選択される。また水素圧と反応温度も選択性に大きな影響を与える。
触媒
[編集]炭素−炭素多重結合の水素化では、白金族金属、あるいはニッケルを不均一系触媒として水素化を行う。炭素−酸素二重結合の水素化では、銅-酸化クロム触媒なども使用される。またベンジル位やエポキシドなどの比較的活性な炭素-ヘテロ原子結合やシクロプロパン環などの炭素-炭素結合が開裂して水素化されることもある。この反応は水素化分解(すいそかぶんかい、Hydrogenolysis)、加水素分解(かすいそぶんかい)と呼ばれる。
使用される金属触媒は表面積が大きくなるようにコロイド状、スポンジ状の形態にした金属触媒、あるいは系内での水素ガスによる還元でそのようになるようにした金属酸化物や金属水酸化物が使用される。前者の代表例にはラネー触媒、後者の代表例にはアダムス触媒がある。
また、活性炭、アルミナなどの不溶性物質を担体として、その表面上に微細な金属を還元的に析出させた金属担体触媒も用いられる。金属担体触媒は経時的な触媒活性の低下が少ないとされており、そのため工業用触媒として優れている。また、リンドラー触媒など金属担体触媒に添加剤を加えて活性度を低下させ、選択性を向上させた被毒触媒も用いられる。これらの不均一系触媒は濾過するだけで容易に回収でき、再利用することが多くの場合可能である。
各種水素化反応に使用される触媒の例
[編集]- C=C二重結合、C≡C三重結合をC−C単結合へ水素化するにはニッケル、ルテニウム、パラジウム、白金が良く用いられる。これらの中からの選択は基質に存在する他の官能基への選択性を考慮して選択される。場合によってはアダムス触媒と呼ばれる酸化白金 PtO2 のような強力な触媒が使用されることもある。
- C≡C三重結合をC=C二重結合に部分還元するには、パラジウムを被毒して活性を低下させたリンドラー触媒がしばしば使用される。
- 芳香環を水素化して飽和の環に還元するにはルテニウム、ロジウムがしばしば使用される。特にロジウムは水素圧が低くても芳香環を還元することができる。ルテニウムは硫黄化合物による被毒を受けないのでチオフェン環の水素化にも利用できる。
- アルデヒドおよびケトンの C=O 二重結合(カルボニル基)を CH−OH (アルコール)へ還元するにはニッケル、銅、ルテニウム、白金が良く用いられる。銅-酸化クロム触媒は C=C 二重結合よりもカルボニル基を選択的に還元できる傾向があるが、この目的にはヒドリド還元の方がすぐれている。
- エステルのカルボニル基を還元するには、銅-酸化クロム触媒が使用されるが高温、高圧の条件が必要となる。
- ベンジルアルコールやベンジルエーテルの C−O 単結合を加水素分解するにはパラジウム触媒が良く用いられる。この方法は有機合成においてアルコールをベンジル保護した後、脱保護するのに用いられる常法である。
- 炭素-硫黄結合を加水素分解するにはニッケル-アルミニウム合金をアルカリで溶解させて調製するラネーニッケル触媒が用いられる。この反応はアルミニウムの溶解の際にニッケルへ吸着された水素による水素化反応である。カルボニル基をジチオアセタールとした後に、この方法を使用するとメチレン基に還元できる。この反応は中性に近い条件で進行し、強酸性下で行われるクレメンゼン還元、強塩基性下で行われるウォルフ・キッシュナー還元の条件で不安定な物質にも適用できる。
被毒
[編集]不均一系触媒の欠点は、反応系内に存在する微量の物質によって大きく触媒活性が低下する、すなわち被毒が起こりやすいことである。
被毒の原因となる物質(触媒毒)としてはルイス塩基であるアミン、硫黄化合物、ホスフィン、ハロゲン化物イオン、一酸化炭素などが知られている。また鉛やビスマスなどの金属イオンが触媒毒となることも知られている。これらの物質は触媒上で反応が進行する場所(活性点)となっている部分に基質より優先的に吸着されるため、触媒活性を大きく低下させると考えられている。触媒毒が有機物の場合には熱などにより脱着させることで低下した活性を再生することが可能である。
被毒は官能基に対する触媒活性によってその程度が異なる場合がある。これを利用して、特定の官能基に対する触媒活性のみを残存させた被毒触媒が調製される。このような例としては酢酸鉛により被毒したリンドラー触媒やローゼンムント還元に用いられるキノリンと硫黄により被毒したパラジウム触媒、ニトロベンゼンからアニリンへの還元に用いられる硫酸ニッケルから調製したニッケル触媒などがある。
反応機構
[編集]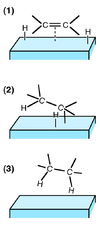
不均一系接触水素化の反応機構は、多くの場合ラングミュア・ヒンシェルウッド機構で起こっているものと推定されている。この機構は基質と水素がそれぞれ触媒に吸着し、触媒上で出会って反応する機構である。水素は吸着の際に水素原子に解離している。この解離には触媒となっている金属表面の格子欠陥が重要な役割を果たしていると考えられている。触媒毒はこの格子欠陥に優先的に吸着して反応を妨げていると考えられている。
不飽和結合への水素の付加は、水素が原子に解離していることから2つの水素原子が別々に付加する2段階反応で起こる。2つの水素原子は基本的には syn の立体選択性で付加する。しかし1段階目の付加、場合によっては2段階目の付加も可逆であり、また逆反応の際には付加した水素原子とは別の水素原子が触媒上に脱離することもある。この結果、不飽和結合の E-Z 異性化や位置の移動が起こることになり、そこから再度水素化が進行することによって多少の立体選択性の低下が見られる。
用途
[編集]実験室レベルでは炭素-炭素多重結合の水素化や保護基として使用したベンジル基の脱保護に使用される。そのほかの反応では、より簡便なヒドリド還元が使用されるのが普通で、水素化が行なわれることは現在では少ない。
一方で、不均一系触媒による接触水素化反応は工業的にもっとも多く使用されている還元反応である。石油の接触改質、接触分解プロセス内における水素化、窒素の水素化によるアンモニアの合成、一酸化炭素の水素化によるメタノールの合成などは特に大規模に行なわれている水素化の例である。 不飽和脂肪酸の水素添加は、マーガリンの製造など食用油脂加工の領域でごく普通に行われている。またエステルからアルコールへの水素化など、高圧を要するため実験室レベルではまず行なわれない反応も、工業的には油脂から得られる高級脂肪酸から高級アルコールの製造などに一般的に使用されている。
均一系触媒による接触水素化
[編集]ウィルキンソン触媒を代表とする白金族金属と配位子との錯体を用いた均一系金属触媒が接触水素化に用いられる。特にキラルな配位子を使うことにより、エナンチオ選択的還元の領域でよく用いられている。
各種水素化反応に使用される触媒の例
[編集]- ウィルキンソン触媒は、炭素-炭素多重結合を炭素-炭素単結合に還元するのに使用される。カルボニル基やニトロ基は還元されない。また反応速度が立体的な影響を大きく受けるので分子内に複数の二重結合を持つ基質で、立体的に空いている二重結合を還元したい場合などに有効である。
- クラブトリー触媒は、ウィルキンソン触媒では還元できないような、反応性の低い4級オレフィンも還元することが出来るイリジウム触媒である。分子内にヒドロキシル基やカルボニル基が存在する場合、立体選択的に還元を行うことが出来る。
- キラルホスフィン-ロジウム錯体は、α,β-不飽和アミノ酸を不斉水素化するのに使用される。二座配位型 C2 対称性を持つホスフィン配位子が有効であることが知られており、これらは多くの場合アルファベットを読み下した略称で呼ばれる。アンリ・カガンらによって開発されたDIOP(ダイオプ)、ウィリアム・ノールズらによって開発されたDIPAMP(ダイパンプ)、野依良治らによって開発されたBINAP(バイナップ)、デュポンのマーク・バークによって開発されたDuPHOS(デュフォス)などである。
- BINAP誘導体-酢酸ルテニウム錯体は、エナミン、α,β-不飽和カルボン酸、アリルアルコール等の不斉水素化に有効である。
- BINAP誘導体-ハロゲン化ルテニウム錯体は、β-ケトエステルの不斉水素化に有効である。
- ホスフィン-エチレンジアミン-ルテニウム錯体は、ケトンのカルボニル基の水素化に有効である。BINAP-光学活性エチレンジアミン-ルテニウム錯体を使用すると不斉水素化が可能である。
反応機構
[編集]金属錯体に水素分子が酸化的付加して生成するジヒドリド錯体、あるいはそこから還元的脱離でヒドリド配位子1つとアニオン性配位子1つが結合して脱離したモノヒドリド錯体が活性種となって進行する反応機構が考えられている。
ウィルキンソン触媒ではジヒドリド錯体にオレフィンが π 配位した後、オレフィンが金属-水素結合に挿入反応してアルキル錯体となり、アルキル配位子がもう一つのヒドリド配位子と還元的脱離して生成物のアルカンとなる。脱離後の触媒には水素分子が酸化的付加することで再びジヒドリド錯体が再生する。
酢酸ルテニウム系の触媒ではモノヒドリド錯体にオレフィンが π 配位した後、オレフィンが金属-水素結合に挿入反応してアルキル錯体となるところまでは同じである。ここで水素分子の酸化的付加が起きてジヒドリド錯体となり、このヒドリド配位子とアルキル配位子が還元的脱離して生成物のアルカンとなり、同時にモノヒドリド錯体が再生する。
ホスフィン-エチレンジアミン-ルテニウム錯体では、カルボニル基はルテニウムには配位せずエチレンジアミンのアミノ基との水素結合により結合しているとされている。ここで H−Ru−N−H・・・O=C がちょうど6員環を形成する形になり、ヒドリド配位子がカルボニル炭素を攻撃して水素化反応が進行する。
その他の水素付加反応
[編集]水素原子の付加に使用可能な置換反応、付加反応は多岐にわたるので、この項では詳細には取り上げない。定義により水素化反応は還元反応の一部分を占めるので、一覧で示された各項目と共に還元反応の項も合わせて参照いただきたい。
一電子移動型還元
[編集]プロトン性溶媒中で亜鉛など還元力が高い金属を作用させると、ハロゲン化物は金属から一電子を受け取りアニオンラジカルとなり、ハロゲン化物イオンの遊離とプロトン化を経て水素化された生成物を与える。液体アンモニア中で芳香族化合物にアルカリ金属を作用させるバーチ還元では、一電子移動によりアニオンラジカルが発生し続いてプロトン化を受け、最終的に二水素付加体が得られる。これらのように、一電子移動を鍵段階とする一連の還元反応を一電子移動型還元と呼ぶ。
金属水素化物によるカルボニルの還元
[編集]水素化アルミニウムリチウムなど金属水素化物をカルボニル基に対して求核的付加反応を施す反応は一級、二級アルコールの製法としてよく用いられている(ヒドリド還元)。
ただし、水素化ナトリウム (NaH) は金属水素化物であるが、ナトリウムのカルボニル酸素との親和性が低いため、ヒドリドは求核性を示さず単なる水素受容体(つまり塩基)として作用する。
食品への応用
[編集]マーガリンやショートニング等の硬化油は、cis-不飽和脂肪酸の水素化によって製造する。融点が上昇して常温下固体となり、料理等で扱いやすくなる。製造時に副生成物としてトランス脂肪酸が数%生成する。
関連項目
[編集]Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
