受容体
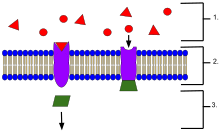
- 細胞外に位置するリガンド
- リガンドは、タンパク質の活性部位の形状に基づいて特定の受容体タンパク質に結合する。
- リガンドが受容体に結合すると、受容体はメッセンジャーを放出する。
生化学および薬理学において、受容体(じゅようたい、英: receptor、レセプター、リセプター)は、生命システムに組み込まれる可能性のあるシグナル(信号)を受信し伝達する、タンパク質からなる化学構造体である[1]。これらのシグナルは通常は化学伝達物質であり[nb 1]、受容体に結合して、何らかの形の細胞/組織応答(例: 細胞の電気的活性の変化など)を引き起こす。受容体の働きは、シグナルの中継、増幅、統合の3つに大きく分類される[2]。シグナルを先方に中継し増幅することで、一つのリガンドの効果を増大させ統合することにより、シグナルを別の生化学的経路に組み込み、その経路もまた高度に専門化することを可能とする[2]。
受容体タンパク質は、その位置によって分類することができる。膜貫通型受容体(transmembrane receptors)には、リガンド依存性イオンチャネル受容体(イオンチャネル型受容体)、Gタンパク質共役ホルモン受容体(代謝型受容体)、酵素結合型ホルモン受容体などがある[1]。細胞内受容体(intracellular receptor)とは、細胞内に存在する受容体のことで、細胞質受容体と核内受容体に分けられる[1]。受容体に結合する分子はリガンド(ligand)と呼ばれ、たとえばタンパク質やペプチド(短いタンパク質)、または神経伝達物質、ホルモン、医薬品、毒素、カルシウムイオン、ウイルスや微生物の外部の一部などの別の小分子である。特定の受容体に結合する内因性の産生物質を内因性リガンドと呼ぶ。たとえば、ニコチン性アセチルコリン受容体の内因性リガンドはアセチルコリンであり、この受容体はニコチンによって活性化され[3][4]、クラーレ(毒物の一種)によって阻害されることもある[5]。それぞれの種類の受容体は、シグナルに対応する固有の細胞生化学的経路に接続している。ほとんどの細胞では多数の受容体が見られるが、それぞれの受容体は特定の構造をもつリガンドとしか結合しない。これは、錠前が特定の形状の鍵のみしか受け入れないことに例えられる。リガンドが対応する受容体に結合すると、受容体に関連する生化学的経路を活性化あるいは阻害する。
構造
[編集]
受容体の構造は非常に多様であり、とりわけ次の主要な分類がある。
- タイプ1 イオンチャネル型受容体 (リガンド依存性イオンチャネル)
- これらの受容体は通常、アセチルコリン(ニコチン様)やGABAなどの高速神経伝達物質の標的であり、これらの受容体の活性化により、膜を横切るイオンの動きに変化が生じる。これらの受容体は、各サブユニットが、細胞外リガンド結合ドメインと4つの膜貫通αヘリックスを含む膜貫通ドメインからなる、ヘテロマー構造を持つ。リガンド結合空洞はサブユニット間の界面に位置している。
- タイプ2 Gタンパク質共役受容体
- これは受容体の中で最大のファミリーで、いろいろのホルモンや、ドーパミン、代謝型グルタミン酸などの緩徐性伝達物質の受容体を含んでいる。これらの受容体は、7つの膜貫通αヘリックスから構成されている。αヘリックスをつなぐループは、細胞外ドメインと細胞内ドメインを形成している。大きなペプチドリガンドの結合部位は、通常、細胞外ドメインに位置し、小さな非ペプチドリガンドの結合部位は、7つのαヘリックスと1つの細胞外ループの間に位置することが多い[6]。前述の受容体は、Gタンパク質を介して異なる細胞内効果器系と結合される[7]。Gタンパク質は、α(アルファ)、β(ベータ)、γ(ガンマ)の3つのサブユニットからなるヘテロ三量体である。不活性状態では、3つのサブユニットが会合し、αサブユニットがグアノシン二リン酸(GDP)に結合する[8]。Gタンパク質が活性化されると構造変化が起こり、GDPをグアノシン三リン酸(GTP)に交換する。αサブユニットにGTPが結合すると、βサブユニットとγサブユニットが解離する[9]。さらに、α、β、γの3つのサブユニットには、一次配列に基づく4つの主要なクラスがある。これらにはGs, Gi, Gq, G12が含まれる[10]。
- タイプ3 キナーゼ結合型受容体および関連受容体(「受容体型チロシンキナーゼ」および「酵素結合型受容体」も参照)
- これらはリガンド結合部位を含む細胞外ドメインと、酵素機能を持つ細胞内ドメインが、1つの膜貫通αヘリックスで連結して構成されることが多い。その一例はインスリン受容体である。
- タイプ4 核内受容体
- 核内受容体と呼ばれているが、実際には細胞質に存在し、リガンドと結合した後に核内に移動する。それらはC末端のリガンド結合領域、コアDNA結合ドメイン(DBD)、およびAF1(activation function 1)領域を含むN末端ドメインで構成されている。コア領域には2本のジンクフィンガーを有し、この受容体に特異的なDNA配列を認識する役割を担う。N末端は、リガンドに依存しない方法で他の細胞内転写因子と相互作用し、これらの相互作用に応じて、受容体の結合/活性を変化させることができる。そのような受容体の例としてステロイド受容体や甲状腺ホルモン受容体がある[11]。
膜受容体は、溶媒、界面活性剤、および(または)親和性精製を用いる複雑な抽出手順により、細胞膜から単離されることがある。
受容体の構造や作用の研究は、X線結晶構造解析、NMR、円偏光二色性、二面偏波式干渉法などの生物物理学的手法で行うことができる。受容体の作用機序を理解するために、受容体の動的挙動のコンピュータシミュレーションも行われている。
結合と活性化
[編集]リガンド結合は平衡過程である。リガンドLと受容体Rについて、リガンドは受容体に結合し、質量作用の法則に従って次式のように解離する。化学種を囲む括弧は、その濃度を表す。
分子が受容体にどれだけよく適合するかを示す一つの指標は結合親和性で、これは解離定数 Kd に反比例の関係がある。良好な適合性は、高い親和性と低い Kd に対応する。最終的な生物学的反応(例: セカンドメッセンジャーカスケード、あるいは筋収縮)は、相当数の受容体が活性化された後にのみ達成される。
親和性(affinity)とは、リガンドがその受容体に結合する傾向の尺度である。効力(efficacy)とは、結合したリガンドがその受容体を活性化するかどうかの尺度である。
アゴニスト対アンタゴニスト
[編集]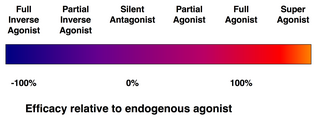
受容体に結合するすべてのリガンドが、その受容体を活性化するわけではない。次のようなリガンドのクラスが存在する。
- (完全)アゴニスト(作用薬または作動薬)は、受容体を活性化し、強い生物学的反応をもたらすことができる。ある受容体に対して最大の効力を持つ天然の内因性 (生物学)リガンドは、定義上、完全アゴニスト(100%の効力)である。
- 部分アゴニスト (英語版) は、最大限に結合しても最大の効力で受容体を活性化しないので、完全アゴニストと比べて部分反応を起こす(効力は0~100%の間)。
- アンタゴニスト(拮抗薬)は、受容体に結合するが、それを活性化しない。その結果、受容体が遮断され、アゴニストや逆アゴニスト(次項)の結合が阻害される。受容体アンタゴニストには、アゴニストと受容体を奪い合う競合型(可逆型)と、受容体と共有結合(または極めて高い親和性の非共有結合)を形成して完全に遮断する不可逆型がある。プロトンポンプ阻害薬オメプラゾールは、不可逆型アンタゴニストの一例である。不可逆型アンタゴニストの効力は、新しい受容体の合成によってのみ回復できる。
- 逆アゴニスト(逆作動薬)は、受容体の構成的活性(後述)を阻害することにより、受容体の活性を低下させる(負の効力)。
- アロステリックモジュレーター(アロステリック調節因子): これらは、受容体のアゴニスト結合部位に結合するのではなく、特定のアロステリック結合部位に結合し、それを通じてアゴニストの作用を変化させる。たとえば、ベンゾジアゼピン(BZD)はGABAA受容体のBZD部位に結合し、内因性GABAの作用を増強する。
受容体のアゴニズムとアンタゴニズムという概念は、あくまでも受容体とリガンドの間の相互作用に言及するものであり、それらの生物学的効果を言及するものではない。
構成的活性
[編集]リガンドと結合が存在しなくても生物学的反応を起こすことができる受容体は、「構成的活性」(constitutive activity)を示すと言われている[12]。受容体の構成的活性は、逆アゴニストによって阻害されることがある。抗肥満薬のリモナバントとタラナバントは、カンナビノイドCB1受容体の逆アゴニストであり、有意な体重減少をもたらしたにもかかわらず、カンナビノイド受容体の構成的活性の阻害に関連すると考えられるうつ病や不安症が好発するために、両方とも中止された。
GABAA受容体は構成的活性を持ち、アゴニストの非存在下で、ある程度の基底電流を伝導する。このため、β-カルボリンは逆アゴニストとして作用し、電流を基底レベル以下に減らすことができる。
思春期早発症(黄体形成ホルモン受容体の変異による)や甲状腺機能亢進症(甲状腺刺激ホルモン受容体の変異による)など、遺伝性疾患の背景には、構成的活性の増加をもたらす受容体の変異がある。
薬物-受容体相互作用の理論
[編集]占拠
[編集]薬理学における受容体理論の初期形成では、薬物の効果は占拠された受容体の数に正比例するとされていた[13]。そのうえ、薬物の効果は薬物-受容体複合体が解離すると消失するというものであった。
Ariëns (英語版) と Stephenson は、受容体に結合したリガンドの作用を説明するために、「親和性」と「効力」という用語を導入した[14][15]。
- 親和性(affinity): 薬物が受容体と結合して薬物-受容体複合体を形成する能力。
- 効力 (英語版) (efficacy): 薬物-受容体複合体が反応を開始する能力。固有活性(intrinsic activity)とも。
速度
[編集]一般に受け入れられた占拠理論(occupation theory)とは対照的に、速度理論(rate theory)では、受容体の活性化は単位時間あたりにおける薬物と受容体との遭遇の総数に正比例すると提案する。薬理活性は、占拠された受容体の数ではなく、解離と会合の速度に正比例する[16]。
- アゴニスト: 速い結合と速い解離を持つ薬物。
- 部分アゴニスト: 中間的会合と中間的解離を持つ薬物。
- アンタゴニスト: 結合が速く解離が遅い薬物。
誘導適合
[編集]薬物が受容体に近づくと、受容体はその結合部位のコンホメーションを変化させて、薬物-受容体複合体を形成する。
スペア受容体
[編集]ある種の受容体系(たとえば、平滑筋の神経筋接合部におけるアセチルコリン)では、アゴニストは、非常に低いレベルの受容体占拠率(1%未満)で最大の反応を引き出すことができる。このように、その系には予備の受容体、または受容体予備軍が存在する。このような配置により、神経伝達物質の生産と放出の経済性が生み出される[11]。
受容体調節
[編集]細胞は、異なる分子に対する感受性を変化させるために、特定のホルモンや神経伝達物質に対する受容体の数を増やす(アップレギュレーション)または減らす(ダウンレギュレーション)ことができる。これは局所的に作用するフィードバック機構である。
- アゴニストの結合が、受容体を活性化しないような、受容体のコンホメーション変化。これはイオンチャネル受容体で見られる。
- 受容体エフェクター分子の解放は、Gタンパク質共役受容体で見られる。
- 受容体の隔離(内在化)[17]。たとえば、ホルモン受容体の場合。
事例とリガンド
[編集]受容体のリガンドは、その受容体と同様に多様である。Gタンパク質共役受容体(GPCR、7TM)は特に広大なファミリーであり、少なくとも810個のメンバーが存在する。また、少なくとも10数種類の内因性リガンドに対するリガンド依存性イオンチャネル(LGIC)も存在し、さまざまなサブユニットによってさらに多くの受容体も構成可能である。リガンドと受容体の一般的な例としては、次のものが挙げられる[18]。
イオンチャネルおよびGタンパク質共役受容体
[編集]イオンチャネル内蔵型(LGIC)および代謝型(具体的にはGPCR)の受容体の例を以下の表に示す。主な神経伝達物質はグルタミン酸およびGABAであり、その他の神経伝達物質は神経調節性である。このリストは決して網羅的なものではない。
| 内因性リガンド | リガンド依存性イオンチャネル (LGIC) | Gタンパク質共役受容体 (GPCR) | ||||
|---|---|---|---|---|---|---|
| 受容体 | イオン電流[nb 2] | 外因性リガンド | 受容体 | Gタンパク質 | 外因性リガンド | |
| グルタミン酸 | イオンチャネル型グルタミン酸受容体 (iGluR): NMDA, AMPA, カイニン酸受容体 | Na+, K+, Ca2+ [18] | ケタミン | グルタミン酸受容体: mGluRs | Gq or Gi/o | - |
| GABA | GABAA受容体
(GABAA-rhoを含む) |
Cl− > HCO−3 [18] | ベンゾジアゼピン | GABAB受容体 | Gi/o | バクロフェン |
| アセチルコリン | ニコチン性アセチルコリン受容体 (nAChR) | Na+, K+, Ca2+[18] | ニコチン | ムスカリン性アセチルコリン受容体 (mAChR) | Gq or Gi | ムスカリン |
| グリシン | グリシン受容体(GlyR) | Cl− > HCO−3 [18] | ストリキニーネ | - | - | - |
| セロトニン | 5-HT3受容体 | Na+, K+ [18] | セレウリド | 5-HT1-2 or 4-7 | Gs, Gi/o or Gq | - |
| ATP | P2X受容体 | Ca2+, Na+, Mg2+ [18] | BzATP[要出典] | P2Y受容体 | Gs, Gi/o or Gq | - |
| ドーパミン | No ion channels[要出典] | - | - | ドーパミン受容体 | Gs or Gi/o | - |
酵素結合型受容体
[編集]酵素結合型受容体には、受容体型チロシンキナーゼ(RTK)、骨形成タンパク質のようなセリン/スレオニン特異的タンパク質キナーゼ、心房性ナトリウム利尿因子受容体のようなグアニル酸シクラーゼがある。RTKのうち、20のクラスが特定されており、58種類のRTKがメンバーとなっている。次にいくつかの例を示す。
| RTKクラス/
受容体ファミリー |
メンバー | 内因性リガンド | 外因性リガンド |
|---|---|---|---|
| I | 上皮成長因子受容体 (EGFR) | 上皮成長因子 (EGF) | ゲフィチニブ |
| II | インスリン受容体 | インスリン | ケトクロミン |
| IV | 血管内皮細胞増殖因子受容体 (VEGFR) | 血管内皮細胞増殖因子 (VEGF) | レンバチニブ |
細胞質受容体
[編集]受容体は、その機構や細胞内の位置に基づいて分類することができる。細胞内LGICの4つの例を以下に示す。
| 受容体 | リガンド | イオン電流 |
|---|---|---|
| 環状ヌクレオチド感受性チャネル | cGMP (vision), cAMP and cGTP (olfaction)
環状グアノシン一リン酸(cGMP) (視覚系), 環状アデノシン一リン酸(aAMP), グアノシン三リン酸(cGTP) (嗅覚系) |
Na+, K+ [18] |
| イノシトールトリスリン酸受容体 (IP3 受容体) | イノシトールトリスリン酸 (IP3) | Ca2+ [18] |
| 細胞内ATP受容体 | ATP (閉チャネル)[18] | K+ [18] |
| リアノジン受容体 | Ca2+ | Ca2+ [18] |
遺伝性疾患における役割
[編集]遺伝性疾患において
[編集]多くの遺伝性疾患では、受容体遺伝子の遺伝的欠陥が関与している。受容体が機能していないのか、ホルモンの産生が低下しているのか、判断するのが困難なことが多い。そのため、ホルモンのレベルが低下しているように見えるが、実際に受容体がホルモンに十分に反応していない内分泌疾患の「偽性-低下症」群を引き起こす。
免疫系内において
[編集]免疫系における主な受容体は、パターン認識受容体(PRR)、トール様受容体(TLR)、キラー活性化およびキラー阻害受容体(KARおよびKIR)、補体受容体、Fc受容体、B細胞受容体およびT細胞受容体である[19]。
注釈
[編集]出典
[編集]- ^ a b c Hall, JE (2016). Guyton and Hall Textbook of Medical Physiology. Philadelphia, PA: Elsevier Saunders. pp. 930–937. ISBN 978-1-4557-7005-2
- ^ a b Alberts, Bruce; Bray, Dennis; Hopkin, Karen; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2014). Essential Cell Biology (Fourth ed.). New York, NY, USA: Garland Science. p. 534. ISBN 978-0-8153-4454-4
- ^ Gotti, Cecilia; Marks, Michael. J.; Millar, Neil S.; Wonnacott, Susan (16 September 2019). “Nicotinic acetylcholine receptors (version 2019.4)”. IUPHAR/BPS Guide to Pharmacology CITE 2019 (4). doi:10.2218/gtopdb/F76/2019.4 17 November 2020閲覧。.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). “Chapter 9: Autonomic Nervous System”. Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. p. 234. ISBN 9780071481274. "Nicotine ... is a natural alkaloid of the tobacco plant. Lobeline is a natural alkaloid of Indian tobacco. Both drugs are agonists of nicotinic cholinergic receptors ..."
- ^ “Curare Drug Information, Professional” (英語). Drugs.com. 8 December 2020閲覧。
- ^ Congreve M, Marshall F (March 2010). “The impact of GPCR structures on pharmacology and structure-based drug design”. British Journal of Pharmacology 159 (5): 986–96. doi:10.1111/j.1476-5381.2009.00476.x. PMC 2839258. PMID 19912230.
- ^ Qin K, Dong C, Wu G, Lambert NA (August 2011). “Inactive-state preassembly of G(q)-coupled receptors and G(q) heterotrimers”. Nature Chemical Biology 7 (10): 740–7. doi:10.1038/nchembio.642. PMC 3177959. PMID 21873996.
- ^ Zubay, Geoffrey (1998). Biochemistry 4th Ed.. Dubuque, IA: William C Brown Pub. pp. 684. ISBN 0697219003
- ^ Garrett, Reginald; Grisham, Charles (2012). Biochemistry. Cengage Learning. pp. 1130. ISBN 9781473733602
- ^ Hamm, Heidi E.; Oldham, William M. (2008). “Heterotrimeric G Protein Activation by G-Protein-Coupled Receptors”. Nature Reviews Molecular Cell Biology (Nature Publishing Group) 9 (1): 60–71. doi:10.1038/nrm2299. PMID 18043707.
- ^ a b Rang HP, Dale MM, Ritter JM, Flower RJ, Henderson G (2012). Rang & Dale's Pharmacology (7th ed.). Elsevier Churchill Livingstone. ISBN 978-0-7020-3471-8
- ^ Milligan G (December 2003). “Constitutive activity and inverse agonists of G protein-coupled receptors: a current perspective”. Molecular Pharmacology 64 (6): 1271–6. doi:10.1124/mol.64.6.1271. PMID 14645655.
- ^ Rang, HP (January 2006). “The receptor concept: pharmacology's big idea”. British Journal of Pharmacology 147 Suppl 1: S9-16. doi:10.1038/sj.bjp.0706457. PMC 1760743. PMID 16402126.
- ^ Ariens EJ (September 1954). “Affinity and intrinsic activity in the theory of competitive inhibition. I. Problems and theory”. Archives Internationales de Pharmacodynamie et de Therapie 99 (1): 32–49. PMID 13229418.
- ^ Stephenson RP (December 1956). “A modification of receptor theory”. British Journal of Pharmacology and Chemotherapy 11 (4): 379–93. doi:10.1111/j.1476-5381.1956.tb00006.x. PMC 1510558. PMID 13383117.
- ^ Silverman RB (2004). “3.2.C Theories for Drug—Receptor Interactions”. The Organic Chemistry of Drug Design and Drug Action (2nd ed.). Amsterdam: Elsevier Academic Press. ISBN 0-12-643732-7
- ^ Boulay G, Chrétien L, Richard DE, Guillemette G (November 1994). “Short-term desensitization of the angiotensin II receptor of bovinde adrenal glomerulosa cells corresponds to a shift from a high to low affinity state”. Endocrinology 135 (5): 2130–6. doi:10.1210/en.135.5.2130. PMID 7956936.
- ^ a b c d e f g h i j k l Boulpaep EL, Boron WF (2005). Medical Physiology: A Cellular and Molecular Approach. St. Louis, Mo: Elsevier Saunders. p. 90. ISBN 1-4160-2328-3
- ^ Waltenbaugh C, Doan T, Melvold R, Viselli S (2008). Immunology. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 20. ISBN 978-0-7817-9543-2
関連項目
[編集]- 結合親和性データベース
- リガンド依存性イオンチャネル
- 神経精神薬理学
- リガンド受容体阻害のためのシルト回帰
- シグナル伝達
- 幹細胞マーカー
- MeSHコードの一覧 (D12.776)
- 受容体説
外部リンク
[編集]- 核内受容体 - 脳科学辞典
- グリシン受容体 - 脳科学辞典
- GABA受容体 - 脳科学辞典
- IUPHAR GPCRデータベースとイオンチャネル概要
- Cell surface receptors - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
![{\displaystyle {[{\ce {L))]+[{\ce {R))]{\ce {<=>[{K_{d))]))[{\text{LR))]))](https://wikimedia.org/api/rest_v1/media/math/render/svg/8bc59879baab1d42236bb74c50da94e2ceef5afd)
