ヴィッティヒ転位
ヴィッティヒ転位 (Wittig rearrangement) は酸素原子の隣りの炭素(α炭素)がカルバニオン化されたエーテルの起こす転位反応である。 特にアリルエーテルの転位反応が進行しやすいため、これがヴィッティヒ転位と呼ばれることが多い。 1942年にゲオルク・ヴィッティヒらによって報告された。
反応形式
[編集]ヴィッティヒ転位においてはいくつかの反応形式が知られている。 いずれもカルバニオン炭素でないほうの酸素原子の隣りの炭素原子(α'位)と酸素原子の間のσ結合が切断され、新たに1つのσ結合が生成することは共通している。 そこで切断されるσ結合の両端にある原子をそれぞれ1位とし、そこから原子をたどって位置番号をつける。 そして新たに生成する原子の位置番号の組み合わせを冒頭に付けて[m,n]-ヴィッティヒ転位と称する。 この方式ではヴィッティヒ転位は3種に分類される。
[2,3]-ヴィッティヒ転位
[編集][2,3]-ヴィッティヒ転位はアリルエーテルに見られる反応形式である。 α'炭素(すなわちアリル位炭素)と酸素間の結合が切断され、α炭素とアリルエーテル二重結合の酸素から遠い側の炭素(γ'炭素)との間に結合が生成する。 同時に二重結合は隣りに移動する。 生成物はホモアリルアルコール(のアルコキシド)である。 ちょうどクライゼン転位の二重結合をカルバニオンで置き換えたものに対応する。
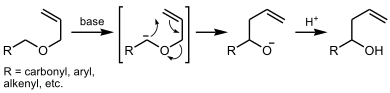
[1,2]-ヴィッティヒ転位
[編集][1,2]-ヴィッティヒ転位は任意のエーテルに見られる反応形式である。 α'炭素と酸素原子の間の結合が切断され、この炭素原子がα炭素と再結合する形式である。

[1,4]-ヴィッティヒ転位
[編集][1,4]-ヴィッティヒ転位はアリルエーテルに見られる反応形式である。カルバニオンが二重結合と共役しているときのみに起こる。[1,2]-ヴィッティヒ転位の変形とみなすことができ、新しい結合の生成が共役した二重結合のγ炭素とα'炭素原子との間で起こるものである。 生成物はアルデヒド(のエノラート)になる。
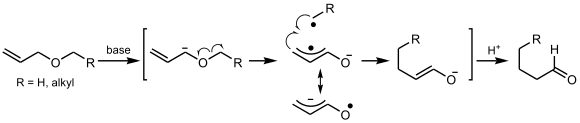
機構は上記のようにラジカルを経由する機構と下記のようにアニオンから協奏的に転位が起こる機構が提案されている。
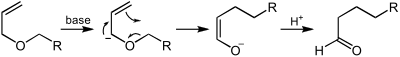
反応条件
[編集]ヴィッティヒ転位を起こすにはα位炭素上の水素を選択的に引き抜く必要がある。 特に[2,3]-ヴィッティヒ転位ではα'位も酸素原子と二重結合で活性化されているため、これよりもα位側が活性化されている必要がある。 そのため、α位にはフェニル基やアルキニル基、シアノ基、カルボニル基などの電子求引性置換基が必要となる。 フェニル基やアルキニル基のような弱い電子求引性基ではブチルリチウムのような強力な塩基がカルバニオンの生成に必要となるが、シアノ基やカルボニル基では水素化ナトリウム程度の強さの塩基でも反応が進行する。
あるいはα位炭素上にトリアルキルスタンニル基 (R3Sn-) を導入しておき、これをアルキルリチウムでトランスメタル化することでもカルバニオンを選択的に発生させることができる。 この変法はスティル-ヴィッティヒ転位 (Still-Wittig rearrangement) と呼ばれる。 他にトリメチルシリル基をフッ化物で除去してカルバニオンを発生させる方法などもある。
[2,3]-ヴィッティヒ転位と[1,2]-ヴィッティヒ転位は競合するが、低温下で反応させることで[2,3]-ヴィッティヒ転位を優先させることができる。 また電子求引性基がカルボニル基の場合、生成するカルバニオンはエノラートとなるのでクライゼン転位が競合する可能性があるが、低温では[2,3]-ヴィッティヒ転位が優先する系が多い。
反応機構
[編集][2,3]-ヴィッティヒ転位
[編集][2,3]-ヴィッティヒ転位はクライゼン転位との類似からも予想できるように、シグマトロピー転位の一種であり反応中間体を持たない協奏的な反応機構により進行する。 基質のα'位に置換基が存在する場合、生成物の二重結合には幾何異性が存在するが、これは(E)-体になることが多い。 またα位とγ'位にともに置換基が存在する場合、生成物にはジアステレオマーが存在するが、この比率は基質の二重結合の幾何異性がよく反映される。 (E)-体の場合にはanti体が、(Z)-体の場合にはsyn体が主生成物となる例が多い。
以上のことから反応の遷移状態は5員環の封筒型配座をとり、封筒の先端にはγ位の炭素が位置していることが推定される。 そしてα'位の置換基が立体障害を避けて封筒の先端と反対側 (exo側)に位置する方が安定となることから(E)-選択性が説明される。 ジアステレオ選択性はα位の置換基が1,3-ジ擬アキシアル反発を避けて擬エクアトリアル位を取るほうが安定となることから説明される。
なお、α'位がキラルな基質について一方のエナンチオマーを用いると、上記の機構から高い光学純度の生成物が得られる。 アリルアルコールのエナンチオマーは入手しやすく、1つの不斉点から2つの不斉点を一度に制御できるため、この反応は鎖状化合物のエナンチオマー合成に有用である。
[1,2]-ヴィッティヒ転位
[編集][1,2]-ヴィッティヒ転位は以下の実験的な事実からラジカル的な結合解裂とその再結合機構で進行していると考えられている。 まずα位とα'位が不斉である場合、生成物の双方の炭素はある程度立体配置が保持されているが、一部ラセミ化も進行する。 仮にこの反応が協奏的機構で進行するとすれば、ウッドワード・ホフマン則からはどちらかの炭素の立体反転が起こること(スプラ-アンタラ型反応)が必要とされ、実験事実と反する。 すなわちこの反応は結合解裂と再結合の二段階からなる。 結合解裂によって生成する反応中間体は、α'位側がシクロブチルエーテルのようにカチオンが容易にきわめて転位を起こす骨格でも維持されることからカルボカチオン中間体は否定される。また転位の反応速度はα'炭素の置換基が多いほど速くなることが知られている。これは炭素ラジカルを生成しているとすると、その安定性から説明できる(カルバニオンは置換基が少ないほど安定なため、逆の傾向になるはずである)。また、生成物についてNMRでCIDNPが観測されることからもラジカル中間体の生成が示唆される。
以上のことから、まず酸素-α'炭素間のσ結合がホモリシスした後、α炭素とα'炭素間でσ結合が生成する機構で反応は進行するものと推定される。 また立体配置がある程度保持されていることから、結合解裂で生成したラジカル対が溶媒内を拡散する前に再結合が起こるものと考えられる。
キラルなアミン配位子を併用する不斉反応が報告されている。
[1,4]-ヴィッティヒ転位
[編集][1,4]-ヴィッティヒ転位は反応形式が[1,2]-転位とビニローグであることからラジカル的機構が考えられる。 しかし、一方でウッドワード・ホフマン則でスプラ-スプラ型の反応が許容となるため、協奏的な反応機構も考えられる。 どちらが正しいかについては結論はでていない。
類似反応
[編集][2,3]-ヴィッティヒ転位はアリルエーテル以外にアリルアミンやアリルスルフィドでも同様の反応が進行することが知られている。 [1,2]-ヴィッティヒ転位に類似した反応としてアンモニウム塩のスティーヴンス転位がある。
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
