メチオニン
| メチオニン | |
|---|---|

| |

| |
Methionine | |
別称 2-amino-4-(methylthio)butanoic acid | |
| 識別情報 | |
| 略称 | Met, M |
| CAS登録番号 | 59-51-8 (DL体), 63-68-3 (L体), 348-67-4 (D体) |
| PubChem | 876 |
| ChemSpider | 853 5907 (L体) |
| UNII | 73JWT2K6T3 |
| EC番号 | 200-432-1 |
| KEGG | D04983 (医薬品、DL体) C00073 (L体) |
| ChEMBL | CHEMBL42336 |
| ATC分類 | V03AB26,QA05BA90 (WHO), QG04BA90 (WHO) |
| |
| |
| 特性[2] | |
| 化学式 | C5H11NO2S |
| モル質量 | 149.21 g mol−1 |
| 外観 | 白色結晶粉末 |
| 密度 | 1.340 g/cm3 |
| 融点 |
281 °C(分解) |
| 水への溶解度 | 可溶 |
| 酸解離定数 pKa | 2.28 (カルボキシル基), 9.21 (アミノ基)[1] |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
メチオニン(英: methionine)は、側鎖に硫黄を含んだ疎水性のアミノ酸である。
概要
[編集]対応するコドンが単一なアミノ酸は2つだけであり、1つはAUGでコードされるメチオニン、もう1つはUGGでコードされるトリプトファンである。コドンAUGはリボソームにmRNAからのタンパク質翻訳を「開始」させるメッセージを送る開始コドンとしても重要である。結果として真核生物および古細菌では全てのタンパク質のN末端はメチオニンになる。しかしながら、これは翻訳中のタンパク質に限るものであり、普通は翻訳完了後に修飾を受けて取り除かれる。メチオニンはN末端以外の位置にも出現する。なお、ヒトにとってメチオニンは必須アミノ酸の1つである。
性質
[編集]血液中のコレステロール値を下げ、活性酸素を取り除く作用がある。ピルビン酸へと代謝する経路が存在するため、糖原性を持つ。
硫黄移動経路によりシステイン、カルニチン、タウリンの生合成や、レシチンのリン酸化などリン脂質の生成に関与する。メチオニンが不適切な変換を受けると動脈硬化症が起こることがある。メチオニンはキレート剤でもある。メチオニンの誘導体である S-アデノシルメチオニン (SAM) はメチル基の供与体としてはたらく。
存在
[編集]メチオニンを多く含む食物として果物、肉、野菜、ナッツ、マメ科の植物があげられる。特にホウレンソウ、グリーンピース、ニンニク、ある種のチーズ、トウモロコシ、ピスタチオ、カシューナッツ、インゲンマメ、豆腐、テンペに豊富に見られる。肉類では鶏肉、牛肉、魚肉など大部分のものに含まれる。
生合成
[編集]メチオニンはヒトの体内で作り出せない必須アミノ酸である。一方、植物や微生物はアスパラギン酸とシステインから生合成を行う。まずアスパラギン酸はβ-アスパルテートセミアルデヒドに変換されるが、これはリシンやスレオニンの生合成経路でも重要である。次にホモセリンアシルトランスフェラーゼによってホモセリンに良い脱離基が付加され、システインと反応してシスタチオニンとなる。これが開裂させられてホモシステインを与え、N5-メチルテトラヒドロ葉酸(N5-methyl-THF)でメチル化されてメチオニンとなる。補因子として、シスタチオニン-γ-シンターゼとシスタチオニン-β-リアーゼは共にピリドキシル-5'-ホスフェートを、ホモシステインメチルトランスフェラーゼはビタミンB12を必要とする。

他の生化学的過程
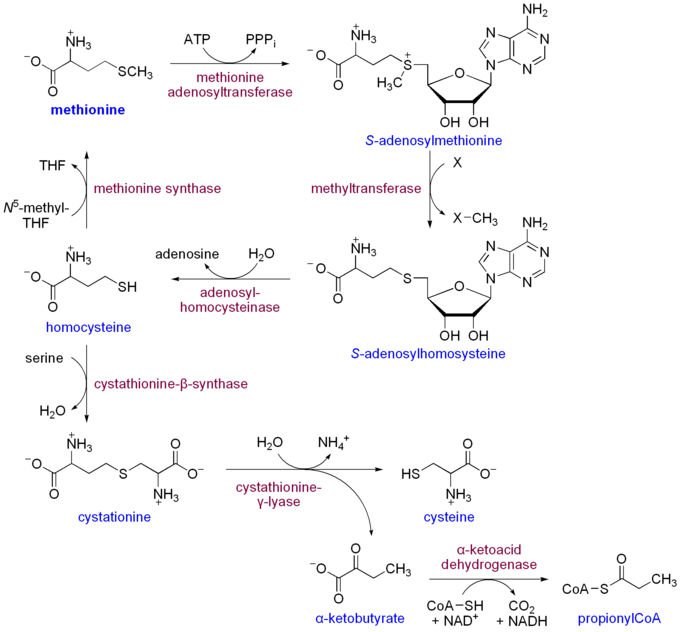
[編集]哺乳類はメチオニンを生合成できないが、様々な生化学的過程において利用している。メチオニンはメチオニンアデノシルトランスフェラーゼによってS-アデノシルメチオニンに変換され、これはメチルトランスフェラーゼによるメチル基移動(メチル化)に用いられる。メチル基の移動後は S-アデノシルホモシステイン (SAH) となり、アデノシルホモシステイナーゼでホモシステインに変換される。
ホモシステインの行く先は2つある。1つはメチオニンシンターゼまたはBHMTによってメチオニンに戻る経路で、もう1つはシステインに変換されるスルフレーション経路である。後者では、まずシスタチオニン-β-シンターゼでセリンと結合されてシスタチオニンとなる。次に(上記の生合成過程ではシスタチオニン-β-リアーゼで分解されるが)、シスタチオニン-β-リアーゼによってシステインと α-ケト酪酸になる。さらにα-ケト酸デヒドロゲナーゼによってα-ケト酪酸はプロピオニルCoAに変換され、最終的にはスクシニルCoA(コハク酸CoA)へと代謝される。
プロピオニルCoAはビオチン依存性酵素であるプロピオニルCoAカルボキシラーゼによって (S)-メチルマロニルCoAに変換される。この生成物はさらにメチルマロニルCoAエピメラーゼによって (R)-メチルマロニルCoAに変換される。(R)-メチルマロニルCoAは、メチルマロニルCoAムターゼによってスクシニルCoAに変換されるが、この酵素は炭素-炭素結合の移動を触媒するためのコバラミン(ビタミンB12)を要する。
代謝性疾患
[編集]以下の代謝性疾患では、メチオニンの分解が障害される:
- ホモシスチン尿症
- マロン酸およびメチルマロン酸尿合併症 (CMAMMA)
- メチルマロン酸血症
- プロピオン酸血症
医薬品としての利用
[編集]既述の通り、メチオニンはヒトの必須アミノ酸の1種であって、また、タンパク質の材料として地球上の生物に広く利用されているため日常生活で食事をすることでも摂取できるわけだが、それとは別に医薬品としても扱われる場合がある。医薬品としては、主に化学物質による中毒の治療を目的として用いられ、1日当たり100 mgから1000 mgを静脈内に注射するといった方法で使用される[3]。
出典
[編集]- ^ Dawson, R.M.C., et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- ^ Weast, Robert C., ed. (1981), CRC Handbook of Chemistry and Physics (62nd ed.), Boca Raton, FL: CRC Press, p. C-374, ISBN 0-8493-0462-8.
- ^ 『L-メチオニン注射液』 p.5、p.6
関連項目
[編集]外部リンク
[編集]- メチオニン - 素材情報データベース<有効性情報>(国立健康・栄養研究所)
| 主なトピック | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 特性 |
| ||||||||||
| 分類 | |||||||||||
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.


