グリコシル化
グリコシル化 (Glycosylation)は、タンパク質もしくは脂質へ糖類が付加する反応である。糖鎖付加(とうさふか)とも言う。この反応は、細胞膜の合成やタンパク質分泌における翻訳後修飾の重要な過程の1つであり、こういった合成の大部分は粗面小胞体で行われる。グリコシル化は、非酵素的糖化反応であるメイラード反応とは対照的に酵素によって管理されている。
グリコシル化にはN-結合型グリコシル化とO-結合型グリコシル化の2つのタイプが存在する。アスパラギン側鎖のアミドのN原子への付加はN-結合型グリコシル化、セリンとトレオニン側鎖のヒドロキシ基のO原子への付加はO-結合型グリコシル化である。
役割
[編集]多糖類鎖は様々な機能を標的のタンパク質へ結びつける。たとえば、いくつかのタンパク質は最初にグリコシル化されない限り正確に折りたたまれない。また、多糖類がアスパラギンのアミドに結合されることによってタンパク質に安定性を与え、いくつかの糖タンパク質を分泌する。実験では、グリコシル化は適切な折りたたみの厳格な必要条件ではないが、グリコシル化しないタンパク質は敏速に退化することが証明されている。グリコシル化は細胞間の接着のような役割も持つ。
機構
[編集]グリコシル化には様々な機構があるが、すべては次のような特徴的な共通点がある。
N-結合型グリコシル化
[編集]
N-結合型グリコシル化は真核生物のタンパク質のいくつかの折り重ねにとって重要である。 N-結合型グリコシル化の過程は、真核生物と広範囲の古細菌で起こるが、ごく稀にバクテリアでも起こる。
N-結合型タンパク質糖鎖において、14糖鎖の前駆体は標的タンパク質のポリペプチド鎖のアスパラギンへ付加される。この前駆体の構造は、一般的な真核生物では、3分子のグルコース、9分子のマンノース、2分子のN-アセチルグルコサミンを含む。この複合体は、キャリアー分子であるドリコールリン酸に結合してポリペプチド鎖の適した位置へ運搬される。
N-結合型糖鎖には主に、高マンノース型糖鎖と複合型糖鎖の2種のタイプがある。
- 高マンノース型糖鎖は、2分子のN-アセチルグルコサミンと多数のマンノース残基からできている。
- 複合型糖鎖は、多種の糖と元々の2分子より多くのN-アセチルグルコサミンを持つ。
タンパク質は、異なる部分で両方の型のグリコシル化ができる。糖鎖が高マンノース型糖鎖か複合型糖鎖かどうかは、ゴルジ体の糖タンパク質に影響を受けやすいためそれに依存すると考えられている。
オリゴ糖鎖は、オリゴ糖トランスフェラーゼ(OST , EC 2.4.1.119)によってトリペプチド配列がAsn-X-SerまたはAsn-X-Thrのアスパラギン(Asn)残基に結合される(Xはプロリン以外のアミノ酸)。この配列は、シークオン(sequon)配列として知られる。結合後、一度タンパク質は正確に折りたたまれ、3つのグルコース残基は鎖から除去され、タンパク質は小胞体から運び出される。糖タンパク質はこのように作られ、余分なマンノース残基を除去するゴルジ体へ輸送される。しかし、グリコシル化はそれ自身タンパク質を標的へ正確に輸送するために必要なものであると考えない人もいる。グリコシル化を抑制する薬品、または突然変異によって欠陥を持ったグリコシル化酵素の研究では、通常のものとは異なった構造のタンパク質が生じたが、これは細胞の生育能力を著しく妨げるとは考えられていない。十分に成長した高マンノース型糖鎖(N-結合型オリゴ糖)は5~9分子のマンノース残基を含んでいる。さらに、マンノース残基が除去され、3分子のマンノースと2分子のN-アセチルグルコサミン残基を含む核構造へ誘導し、ガラクトース、N-アセチルグルコサミン、N-アセチルガラクトサミン、フコースそしてシアル酸で延長されると複合型糖鎖となる。
-
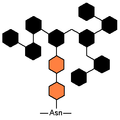
高マンノース型糖鎖。橙はN-アセチルグルコサミン、黒はマンノース。
-
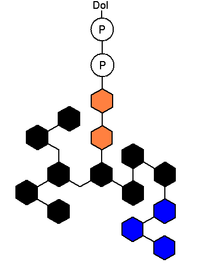
複合型糖鎖。橙はN-アセチルグルコサミン、黒はマンノース、紫はフコース、緑はガラクトース、黄色はシアル酸。
O-結合型グリコシル化
[編集]O-N-アセチルガラクトサミン (O-GalNAc)
[編集]
O-結合型グリコシル化は、タンパク質処理の間の後期段階にゴルジ体で起こる。これは、UDP-N-アセチル-D-ガラクトサミン:ポリペプチド N-アシルガラクトサミニルトランスフェラーゼ(EC 2.4.1.41)によるセリンまたはトレオニン残基へのN-アセチルガラクトサミンの付加反応で、他の炭水化物(例えばガラクトースやシアル酸)がその次に続く。この過程は、始めに非グリコシル化されたプロテオグリカン核タンパク質へのグリコサミノグリカン鎖(GAG)の付加を必然的に含むプロテオグリカンのようなタンパク質の型にとって重要である。それらの付加は、通常はセリンO-糖タンパク質で、それは2つの主な機能のうち1つの機能を持つと考えられている。1つの機能は細胞外マトリックスの構成を形成するための分泌作用で必然的に含み、プロテオグリカンの大きな糖の複合体間の相互作用で細胞同士を付着させる。その他の機能は、粘膜の分泌作用を構成する動作で、それは炭水化物が高濃度になった物で「ねばねば」とした粘液を与える。血中で循環するタンパク質は、イムノグロブリンAとイムノグロブリンDの2つの抗体とC1インヒビターの例外を除いて正常にO-グリコシル化はしない。
O-フコース
[編集]O-フコースは、ノッチタンパク質のEGF様反復配列(EGF-like repeats)のコンセンサス配列が-C2-X-X-G-G-S/T-C3-の場所に付加する。C2とC3はそれぞれ2番目と3番目に保存されたシステインで、Gはグリシン、S/TはO-フコースが結合するセリン/トレオニン、Xは任意のアミノ酸である。この反応は、GDP-フコースタンパク質O-フコシルトランスフェラーゼ1(POFUT1)及びGDP-フコースタンパク質O-フコシルトランスフェラーゼ2(POFUT2)の2つの酵素で行われる。O-フコースには順番にN-アセチルグルコサミン(GlcNAc)、ガラクトース、シアル酸の3つの単糖が結合し、トロンボスポンジン反復配列では、グルコースが1つ付加する。2種類のフコシルトランスフェラーゼは小胞体に配置されており、グリコシルトランスフェラーゼはゴルジ体に配置されている。
O-グルコース
[編集]O-グルコースは、ノッチタンパク質のEGF様反復配列(EGF-like repeats)のコンセンサス配列が-C1-X-S-X-P-C2-の場所に付加する。C1とC2はそれぞれ1番目と2番目に保存されたシステインで、SはO-グルコースが付加するセリン、Pはプロリン、Xは任意のアミノ酸である。また、O-グルコースにはα1,3結合で1~2個のキシロースが結合している。
O-N-アセチルグルコサミン (O-GlcNAc)
[編集]O-GlcNAcは、O-GlcNAcトランスフェラーゼによってセリンまたはトレオニンへ付加される。O-GlcNAcはセリンとトレオニンに生じるが、同時にセリン/トレオニンにはリン酸化も起こる。つまり、もしセリン/トレオニンにリン酸化が起こるとO-GlcNAc修飾は生じず、逆にO-GlcNAcが現れるとリン酸化は起こらない。リン酸化とO-GlcNAcは拮抗関係にあると言える。これはリン酸化/脱リン酸化が細胞内シグナルの調節になるため自然科学上のパラダイムとなる非常に重要な発見である。現在、癌の調査がリン酸化に焦点を向けられ研究が進められている。また、O-GlcNAcの付加と除去は糖尿病の発症において、重要な調整機構である。
GPIアンカー
[編集]グリコシル化の特殊構造はGPIアンカー(グリコホスファチジルイノシトール)という。グリコシル化のこの構造にはグリカンを介在にして疎水性の脂質をタンパク質に繋ぎ止める働きをもつ。(プレニル化を参照)
C-マンノシル化
[編集]マンノースは、トロンボスポンジン(TSP)タンパク質のトリプトファン残基へ付加する。糖が窒素または酸素のような反応しやすい原子ではなく炭素へ結合し、アスパラギン/セリン/トレオニンではなくトリプトファン残基に結合するためこれは例外的な修飾である。
関連項目
[編集]| 全般 | |
|---|---|
| N末端 | |
| C末端 | |
| リシン | |
| システイン | |
| セリン/トレオニン | |
| チロシン | |
| アスパラギン | |
| アスパラギン酸 | |
| グルタミン | |
| グルタミン酸 | |
| アルギニン | |
| プロリン | |
| 一般 | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| エネルギー代謝 |
| ||||||||||||||||||||||||||||||||
| 特定経路 |
| ||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.