L-DOPA
Da Wikipedia, l'enciclopedia libera.
| L-DOPA | |
|---|---|
 | |
 | |
| Nome IUPAC | |
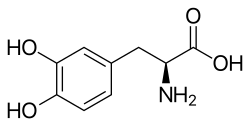
| acido 2S-ammino-3-(3,4-diidrossifenil)propanoico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C9H11NO4 |
| Massa molecolare (u) | 197,19 g/mol |
| Numero CAS | |
| Numero EINECS | 200-445-2 |
| Codice ATC | N04 |
| PubChem | 6047 e 6971033 |
| DrugBank | DBDB01235 |
| SMILES | C1=CC(=C(C=C1CC(C(=O)O)N)O)O |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida (pKa) a 298 K | 2,3; 8,7; 10,0; 11,8 |
| Temperatura di fusione | 276-278 °C (dec.) |
| Dati farmacocinetici | |
| Biodisponibilità | 30% |
| Metabolismo | DOPA decarbossilasi (AAAD) |
| Emivita | 0,75-1,50 ore |
| Escrezione | renale 70-80% |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 302 - 315 - 319 - 335 |
| Consigli P | 261 - 305+351+338 [1] |
L'L-DOPA, o levodopa, è un amminoacido intermedio nella via biosintetica della dopamina. In clinica medica è utilizzata per il trattamento della malattia di Parkinson e di alcuni parkinsonismi per controllare i sintomi bradicinetici evidenti nella malattia ed è il farmaco più efficace per migliorare la qualità della vita nei pazienti con malattia di Parkinson idiopatica.
Chimica
[modifica | modifica wikitesto]L'L-DOPA, ovvero la L-3,4-diidrossifenilalanina (in inglese DiOxyPhenylAlanine da cui l'acronimo), è un α-amminoacido non proteico, strutturalmente simile alla L-fenilalanina e, soprattutto, alla L-tirosina dalla quale deriva e con la quale condivide l'appartenenza alla serie sterica L di Fischer (comune a tutti i comuni amminoacidi proteici).
È una sostanza cristallina bianca, inodore, insapore e altofondente (276-278 °C),[2] che come gli altri amminoacidi esiste in forma zwitterionica (punto isoelettrico pI = 5,5). Come la maggior parte dei fenoli si ossida all'aria, specialmente se umida, colorandosi. È poco solubile in acqua e insolubile nei comuni solventi organici.
L'L-DOPA è otticamente attiva e levogira, [α]D13 = −13,1°.[2] Occorre tener presente che non c'è alcuna correlazione tra il segno (−) dell'attività ottica (da cui il nome levodopa) e la serie sterica di appartenenza (L).

L'L-DOPA è biosintetizzata per azione della tirosina idrossilasi sull'amminoacido L-tirosina. È il precursore d'importanti neurotrasmettitori catecolaminici, quali dopamina, noradrenalina (norepinefrina) e adrenalina (epinefrina). In particolare, la dopamina si forma per decarbossilazione enzimatica della L-DOPA.
Uso terapeutico
[modifica | modifica wikitesto]La malattia di Parkinson è causata dalla perdita di neuroni dopaminergici a livello della pars compacta della sostanza nera compatta del mesencefalo. La conseguente diminuzione di dopamina in questa area e lo squilibrio eccitatorio inibitorio che ne deriva sarebbe responsabile dei disturbi extrapiramidali tipici di chi è afflitto da tale patologia. La L-DOPA è utilizzata come profarmaco della dopamina nel trattamento del Parkinson, in quanto quest'ultima non è in grado di attraversare la barriera ematoencefalica, mentre la L-DOPA, grazie a un sistema di trasporto di amminoacidi, riesce a entrare nel sistema nervoso centrale e una volta qui viene metabolizzata in dopamina, avvalendosi di un enzima (l'DOPA decarbossilasi). Il presupposto clinico dell'uso dell'L-DOPA parte proprio dall'osservazione di una carenza di dopamina nella sostanza nera e non essendo utile la somministrazione di questa si adopera la L-DOPA per ripristinare i livelli di dopamina in questa zona. Nella pratica medica si somministrano circa 100 mg di L-DOPA e 25 di benserazide.
Avvertenze
[modifica | modifica wikitesto]Interruzione della terapia con L-DOPA: la sospensione repentina di L-DOPA potrebbe scatenare la comparsa di sindrome maligna (SM). Tale sindrome, simile alla sindrome neurolettica maligna, è caratterizzata da ipertermia, rigidità e aumentata concentrazione di creatin-fosfochinasi sierica; altri sintomi comprendono ipo/ipertensione, tachicardia, sudorazione, aumento degli enzimi epatici e leucocitosi. Nei pazienti in terapia dopaminergica la comparsa d'ipertermia (temperatura corporea > 38 °C) senza causa apparente, eventualmente associata a rigidità e stupor, potrebbe indicare sindrome maligna da interruzione del trattamento con L-DOPA[3]. La sindrome maligna può essere causata anche dalla sospensione di farmaci anti-parkinsoniani diversi dall'L-DOPA e dal fenomeno di wearing off (diminuzione dell'attività del farmaco dopo anni di terapia). Il trattamento della sindrome maligna prevede la somministrazione endovena di liquidi, l'abbassamento della temperatura corporea, il ricorso a farmaci dopaminergici quali L-DOPA e bromocriptina, a miorilassanti (dantrolene sodico) e antibiotici se presenti infezioni. Gravi complicanze della sindrome maligna sono rappresentate da rabdomiolisi, insufficienza renale acuta e coagulazione intravascolare disseminata[4].
Farmacocinetica
[modifica | modifica wikitesto]L'L-DOPA viene somministrata per via orale e assorbita a livello intestinale da carrier per gli amminoacidi aromatici, per poi entrare nel circolo sistemico. In periferia esiste un enzima, la DOPA decarbossilasi (presente anche a livello centrale) che catalizza la trasformazione dell'L-DOPA in dopamina. Poiché la dopamina a livello periferico non ha effetti terapeutici, ma anzi è causa di spiacevoli effetti collaterali, si cerca d'inibire la dopa decarbossilasi periferica con la somministrazione contemporanea di inibitori della decarbossilasi, quali carbidopa e benserazide, in modo che possa essere maggiore la quantità di L-DOPA che giunge nel sistema nervoso centrale. Giunta nel cervello, l'L-DOPA viene captata dalle terminazioni dopaminergiche, dove, per azione di uno specifico carrier, penetra nei neuroni e viene trasformata in dopamina dalla dopa decarbossilasi. La dopamina prodotta, accumulata in vescicole sinaptiche, viene poi liberata nel vallo sinaptico per agire sui neuroni post-sinaptici ed esplicare il proprio effetto terapeutico.
Il sistema nervoso centrale non è però costituito unicamente da neuroni, ma sono presenti anche altre cellule, definite gliali, che hanno funzione trofica e di sostegno (sostanzialmente sorreggono fisicamente e metabolicamente i neuroni). Anche le cellule gliali posseggono la dopa decarbossilasi, ma, al contrario dei neuroni, non sono in grado d'immagazzinare la dopamina prodotta, che viene perciò immediatamente degradata. Quote rilevanti di L-DOPA sono perciò metabolizzate in dopamina dalle cellule gliali senza che se ne possa avere un beneficio terapeutico.
Effetti collaterali
[modifica | modifica wikitesto]La dopamina e i neuroni dopaminergici controllano il centro del vomito, localizzato nel pavimento del IV ventricolo del tronco encefalico; lo stimolo del vomito e la nausea che talvolta si accompagnano alla somministrazione dell'L-DOPA possono essere attenuate mangiando quindici minuti dopo l'assunzione del farmaco ed è importante evitare cibi ricchi di amminoacidi aromatici che diminuiscono l'assorbimento dell'L-DOPA.
Poiché il morbo di Parkinson è una patologia neurodegenerativa continua che non è possibile ancora bloccare, dopo 2-5 anni di terapia con L-DOPA è possibile rilevare una diminuzione della sua attività. Tale effetto è definito wearing off, cioè una diminuzione dell'attività dell'L-DOPA dovuta alla progressiva distruzione dei neuroni dopaminergici. Accanto a tale effetto si può descrivere il periodo on-off, che è una fluttuazione dell'attività dell'L-DOPA causata da diversi fattori: variazione dell'assorbimento intestinale di L-DOPA; bassa emivita del farmaco (1-2 ore) che causa fluttuazioni plasmatiche e quindi fluttuazioni della risposta motoria; variazione della dinamica recettoriale della dopamina: se esponiamo un recettore ad alte concentrazioni di ligando, il recettore può subire un processo definito di desensitizzazione, che è causa della diminuita attività del farmaco.
Effetti collaterali: tra i più frequenti si possono così evidenziare: wearing off, periodo on-off, nausea (meno frequente se al farmaco si associa la carbidopa), vomito, inappetenza, anoressia, ipotensione ortostatica, aritmie, turbe psichiche e discinesie.
L'L-DOPA rimane ancora il farmaco di scelta nella terapia antiparkinsoniana, sebbene sia possibile coadiuvarne l'attività con altri farmaci e ne siano ampiamente riconosciuti i limiti.
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 05.11.2012
- ^ a b Shun-ichi Yamada, Tozo Fujii e Takayuki Shioiri, Studies on Optically Active Amino Acids. III. Preparation of 3-(3, 4-Dihydroxyphenyl)-DL-, -D-, and -L-alanine, in Chemical & Pharmaceutical Bulletin, vol. 10, n. 8, 1º gennaio 1962, pp. 693-697, DOI:10.1248/cpb.10.693. URL consultato il 2 dicembre 2015.
- ^ Ward C., J. Neurosci. Nurs., 2005, 37 (3), 160
- ^ Ikebe S. et al., Parkinsonism Relat. Disord., 203, 9 Suppl. 1, S47
Bibliografia
[modifica | modifica wikitesto]- Parkinson e nutrizione, su lswn.it. URL consultato il 18 febbraio 2008 (archiviato dall'url originale il 30 dicembre 2007).
- Dizionario medico, su ok.corriere.it.
- (EN) L-DOPA: From a biologically inactive amino acid to a successful therapeutic agent Historical review art, su biopsychiatry.com.
- (EN) Levodopa (L-Dopa), Kavita R. Gandhi; Abdolreza Saadabadi, 27 ottobre 2020, su ncbi.nlm.nih.gov.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su L-DOPA
Wikimedia Commons contiene immagini o altri file su L-DOPA
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
