Effetto anomerico
Da Wikipedia, l'enciclopedia libera.
In chimica organica, l'effetto anomerico è un effetto elettronico che consiste nella tendenza per i sostituenti eteroatomici di un cicloesano posizionati accanto ad un eteroatomo all'interno dell'anello ad occupare la posizione assiale a dispetto di quella equatoriale, che sarebbe invece favorita energicamente secondo considerazioni di ingombro sterico.[1] Questo effetto fu originariamente osservato in alcuni carboidrati (i piranosi) da J. T. Edward nel 1955: la dicitura anomerico deriva dal nome assegnato al carbonio-1 dei piranosi, chiamato carbonio anomerico. Gli isomeri che differiscono in configurazione solo al carbonio anomerico vengono definiti anomeri.
Origine fisica
[modifica | modifica wikitesto]L'origine fisica dell'effetto anomerico può essere attribuita a due cause principali: la disposizione dei dipoli elettrici e l'iperconiugazione.
La configurazione equatoriale in un sistema descritto poc'anzi vedrebbe infatti i dipoli elettrici dei due eteroatomi coinvolti essere parzialmente allineati, e pertanto repellersi fra di loro. Nella conformazione assiale invece i dipoli sono opposti, rappresentando uno stato ad energia più bassa e perciò più stabile.
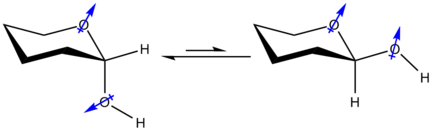
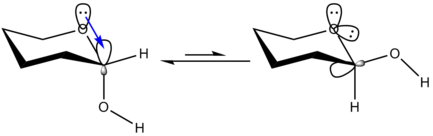
La spiegazione alternativa deriva dalla teoria degli orbitali molecolari e illustra l'esistenza di una interazione stabilizzante (iperconiugazione) fra il doppietto elettronico di un eteroatomo (quello all'interno dell'anello) con l'orbitale σ* del legame assiale C-X. Questa interazione non può esistere nella configurazione equatoriale poiché gli orbitali non sono correttamente allineati.
Conseguenze chimiche
[modifica | modifica wikitesto]L'effetto anomerico, derivante dalla parziale sovrapposizione dell'orbitale di non legame dell'ossigeno con l'orbitale σ* del legame assiale C-X, porta ad un legame C-O più corto e forte di un normale legame singolo, ed un legame C-X più lungo e debole di un legame singolo. La principale conseguenza di questo indebolimento è che un glicoside di tipo α può essere rotto più facilmente. Ad esempio l'amilosio, con un legame glicosidico α-1,4' può essere idrolizzato più facilmente rispetto alla cellulosa che presenta un legame di tipo β-1,4'.
Note
[modifica | modifica wikitesto]- ^ (EN) Anomeric effect, in Compendium of Chemical Terminology, IUPAC, 2006. URL consultato il 10 aprile 2012.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Effetto anomerico
Wikimedia Commons contiene immagini o altri file su Effetto anomerico
| Controllo di autorità | GND (DE) 4278267-3 |
|---|
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
