Anidride iodica
Da Wikipedia, l'enciclopedia libera.
| Anidride iodica | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| pentossido di diiodio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | I2O5 |
| Massa molecolare (u) | 317,80 |
| Aspetto | solido bianco cristallino[1] igroscopico |
| Numero CAS | |
| Numero EINECS | 234-740-2 |
| PubChem | 159402 |
| SMILES | O=I(=O)OI(=O)=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 4,98 (20 °C)[1] |
| Solubilità in acqua | (20 °C) solubile |
| Temperatura di fusione | 300 °C (decomp)[2] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 272 - 314 |
| Consigli P | 220 - 280 - 305+351+338 - 310 [3] |
L'anidride iodica o pentossido di diiodio è l'anidride che si forma dall'unione di ossigeno gassoso e iodio con stato di ossidazione = 5.
A temperatura ambiente si presenta come un solido bianco giallastro inodore, con forti proprietà ossidanti.
Struttura
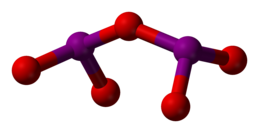
[modifica | modifica wikitesto]I2O5 è piegato con un angolo I-O-I di 139.2°, ma la molecola non ha piani speculari così la sua simmetria non è C2v. Le distanze I-O laterali sono circa 0.18 nm e quella centrale (ponte) circa 0.195 nm[4].
Sintesi
[modifica | modifica wikitesto]L'anidride iodica non può venire preparata per sintesi diretta tra iodio ed ossigeno in quanto lo iodio è poco reattivo in confronto a quest'ultimo, ma viene ottenuta disidratando l'acido iodico a 200 °C.
Reazioni
[modifica | modifica wikitesto]Il pentossido di iodio ossida facilmente il monossido di carbonio ad anidride carbonica a temperatura ambiente:
Questa reazione può essere usata per analizzare la concentrazione di CO in un campione gassoso.
I2O5 forma il catione [IO2+], con SO3 e S2O6F2, ed il catione [IO+], con acido solforico concentrato.
Note
[modifica | modifica wikitesto]- ^ a b Greenwood, Norman N.; Earnshaw, A., Chemistry of the Elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, pp. 851-852, ISBN 0-08-037941-9.
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Sigma Aldrich; rev. del 02.01.2011
- ^ K. Selte and A. Kjekshus, Iodine oxides: part III, The crystal structure of I2O5, in Acta Chem. Scand., vol. 24, 1970, pp. 1912–1914, DOI:10.3891/acta.chem.scand.24-1912.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su anidride iodica
Wikimedia Commons contiene immagini o altri file su anidride iodica
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.


