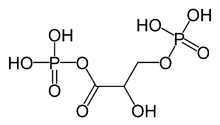
1,3-bisfosfoglicerato
Da Wikipedia, l'enciclopedia libera.
| 1,3-bisfosfoglicerato | |
|---|---|
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C3H8O10P2 |
| Massa molecolare (u) | 266,04 |
| Numero CAS | |
| PubChem | 683 |
| SMILES | C(C(C(=O)OP(=O)(O)O)O)OP(=O)(O)O |
| Indicazioni di sicurezza | |
L'1,3-bisfosfoglicerato (abbreviato come 1,3BPG o BPG, dall'inglese BisPhosphoGlycerate), è una molecola a 3 atomi di carbonio presente nella quasi totalità degli organismi viventi. Il suo ruolo è fondamentale in due processi metabolici fondamentali come la glicolisi (nel corso della respirazione cellulare) ed il ciclo di Calvin, nel corso della fotosintesi. In entrambe le reazioni, questa molecola è di fatto la transizione tra la gliceraldeide-3-fosfato ed il 3-fosfoglicerato.
Struttura e ruolo biologico
[modifica | modifica wikitesto]L'1,3-bisfosfoglicerato è una forma anionica dell'acido fosfoglicerico con due gruppi fosfato sui carboni 1 e 3. Il risultato di questa fosforilazione rende l'1,3BPG una molecola delle importantissime funzionalità biologiche, come ad esempio quella di fosforilare una molecola di ADP, ricaricandola ad ATP, la molecola fondamentale per il trasporto di energia.
Ruolo nella glicolisi
[modifica | modifica wikitesto]Come già detto, l'1,3-BPG è un intermedio metabolico del pathway glicolitico. Viene prodotto dalla ossidazione esoergonica del gruppo aldeidico presente sulla gliceraldeide-3-fosfato. Il risultato di questa reazione è la formazione di un acido carbossilico, che va a formare un legame con un gruppo fosfato. Tale reazione, catalizzata dall'enzima gliceraldeide-3-fosfato deidrogenasi, vede anche la conversione di una molecola di NAD+ in NADH.
Il legame acilico del fosfato è ad alta energia: per questo motivo, l'1,3-BPG è fondamentale per la ricarica di una molecola di ADP in ATP. La reazione successiva della glicolisi, infatti, è proprio una fosforilazione al livello del substrato. La reazione completa è:
- 1,3-bisfosfoglicerato + ADP ⇌ 3-fosfoglicerato + ATP
La reazione di trasferimento di un fosfato dal gruppo carbossilico dell'1,3-BPG ad una molecola di ADP a formare ATP è reversible: essa infatti ha una bassa ΔG. Questo è dovuto al fatto che essa consiste nella rottura di un legame acilico su una molecola e nella formazione di un legame acilico analogo su un'altra. La reazione, in ogni caso, non è spontanea: per questo motivo, è necessaria la presenza di un catalizzatore, l'enzima fosfoglicerato chinasi. Nel corso della reazione, l'enzima va incontro ad un cambiamento conformazionale indotto dalla presenza del substrato, come avviene anche in un'altra chinasi coinvolta nella glicolisi, la esochinasi.
Dal momento che nel corso della glicolisi due molecole di gliceraldeide-3-fosfato (e quindi due di 1,3-BPG) si formano a partire da una di glucosio, si può affermare che l'1,3-BPG sia responsabile della produzione di due delle quattro molecole di ATP generate nel corso del pathway.
Ruolo nel ciclo di Calvin
[modifica | modifica wikitesto]L'1,3-BPG nel ciclo di Calvin ha un ruolo molto simile a quello che riveste nella glicolisi. Le reazioni in cui è coinvolto nei due pathway sono infatti del tutto simili, per quanto invertite. La vera differenza tra le due reazioni consiste nel fatto che nel ciclo di Calvin il coenzima coinvolto è il NADPH (usato come donatore di elettroni nel ciclo di Calvin) anziché il NAD+ (accettore di elettroni nella glicolisi).
Nel ciclo di Calvin, l'1,3-BPG si origina dal 3-fosfoglicerato, attraverso una fosforilazione mediata dalla fosfoglicerato chinasi, e viene processato a gliceraldeide-3-fosfato dall'azione della gliceraldeide-3-fosfato deidrogenasi. Contrariamente a quanto accade nella glicolisi, la reazione catalizzata dalla fosfoglicerato chinasi non produce ma consuma una molecola di ATP (ed infatti si svolge in senso inverso). Per questo motivo, la formazione di 1,3-BPG può essere considerata uno step irreversibile del ciclo. Il risultato della seconda reazione è la produzione di un fosfato inorganico e la formazione di NADP+. L'enzima gliceraldeide-3-fosfato deidrogenasi, infatti, catalizza la riduzione del gruppo carbossile dell'1,3BPG ad ottenere una aldeide. L'energia contemporaneamente rilasciata dalla de-fosforilazione del substrato viene utilizzata per la conversione di NADPH to NADP+.
Ruolo dell'1,3-bisfosfoglicerato in medicina
[modifica | modifica wikitesto]Durante il normale metabolismo umano, circa il 20% dell'1,3-BPG prodotto non viene ulteriormente processato nel pathway glicolitico. Esso è invece coinvolto in una via metabolica alternativa che coinvolge la riduzione dell'ATP negli eritrociti. Questo pathway porta alla formazione di un trioso analogo all'1,3BPG: il 2,3-bisfosfoglicerato. Il 2,3-BPG è utilizzato per controllare il rilascio dell'ossigeno dall'emoglobina.
I livelli ematici dell'1,3-BPG si alzano negli individui che hanno bassi livelli di ossigeno ematico (ad esempio in corso di fenomeni di acclimatamento). Bassi livelli di ossigeno, infatti, inducono un aumento dei livelli di 1,3-BPG ed un conseguente aumento di 2,3-DPG, che modifica l'efficienza della dissociazione dell'ossigeno dall'emoglobina. Si tratta, in questo caso, di un esempio di regolazione a feedback negativo.
Bibliografia
[modifica | modifica wikitesto]- Stryer et al. Biochemistry 5th Edition. WH Freeman & Co Ltd, 2002. ISBN 0-716746-84-0
- Alberts et al. Molecular Biology of the Cell. Garland Science, 2001. ISBN 0-815340-72-9
- Germann, W. Principles of Human Physiology. Addison Wesley, 2004. ISBN 0-321248-62-7
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su 1,3-bisfosfoglicerato
Wikimedia Commons contiene immagini o altri file su 1,3-bisfosfoglicerato
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) L'1,3BPG nella glicolisi e nelle fermentazioni, su rpi.edu. URL consultato il 22 agosto 2006 (archiviato dall'url originale il 16 luglio 2006).
- (EN) Voce sull'1,3BPG da un dizionario medico, su mercksource.com. URL consultato il 22 agosto 2006 (archiviato dall'url originale il 22 giugno 2006).
- (EN) 1,3BPG substrato enzimatico: meccanismi catalitici, su content.febsjournal.org. URL consultato il 22 agosto 2006 (archiviato dall'url originale il 14 aprile 2013).
- (EN) 1,3BPG nella fotosintesi [collegamento interrotto], su courses.cm.utexas.edu.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
